
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素

(1)表格中最稳定的元素是_____(填元素符号),h在周期表的位置为_____。
(2)元素i的最高价氧化物对应水化物的化学式为_____
(3)c、d、e三种元素对应的原子半径由大到小的顺序为_____(用元素符号表示)
(4)c、h气态氢化物的稳定性强弱关系是_____(用化学式表示)
(5)写出f和i形成的化合物中所含化学键的类型_____
【答案】Ar 第三周期ⅤA族 HClO4 Na>N>O NH3>PH3 离子键
【解析】
由元素在周期表的位置可知,a~j分别为H、C、N、O、Na、Mg、Al、P、Cl、Ar,
(1)稀有气体最稳定,h为P;
(2)i的最高价为+7价;
(3)电子层越多、原子半径越大,同周期从左向右原子半径减小;
(4)非金属性越强,对应氢化物越稳定;
(5)f和i形成的化合物为MgCl2。
由元素在周期表的位置可知,a~j分别为H、C、N、O、Na、Mg、Al、P、Cl、Ar,
(1)表格中最稳定的元素是Ar,h在周期表的位置为第三周期ⅤA族,故答案为:Ar;第三周期ⅤA族;
(2)元素i的最高价氧化物对应水化物的化学式为HClO4,故答案为:HClO4;
(3)c、d、e三种元素对应的原子半径由大到小的顺序为Na>N>O,故答案为:Na>N>O;
(4)c、h气态氢化物的稳定性强弱关系是NH3>PH3,故答案为:NH3>PH3;
(5)f和i形成的化合物中所含化学键的类型为离子键,故答案为:离子键。


科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)有广泛的用途,实验室中通过如下方法制备:
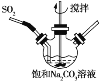
①不断搅拌条件下,在饱和Na2CO3溶液中缓缓通入SO2至反应完全;
②取下三颈烧瓶,测得反应液的pH=4.1;
③将溶液蒸发浓缩、结晶、过滤得焦亚硫酸钠晶体。
请回答下列问题:
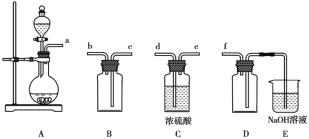
(1)实验室可利用Na2SO3和较浓的硫酸制备少量SO2气体,该反应的化学方程式为_______________。硫酸浓度太大不利于SO2气体逸出,原因是_____________。制备、收集干燥的SO2气体时,所需仪器如下。装置A是气体发生装置,按气流方向连接各仪器口,顺序为a→____→____→____→____→f。装置D的作用是__________。
(2)步骤①反应的离子方程式为________________,合成Na2S2O5的总化学方程式为__________________。
(3)在强碱性条件下利用Na2S2O5氧化HCOONa的方法可制备保险粉连二亚硫酸钠(Na2S2O4),反应的离子方程式为___________。
(4)工业上用焦亚硫酸钠法制备保险粉带来的主要问题是废水中含有大量的有机物,有机物总含碳量用TOC表征,常采用Fenton 氧化法去除废水中的有机物,即通过向废水中加入H2O2,以Fe2+作催化剂,产生具有强氧化性的羟基自由基(·OH)来氧化降解废水中的有机物。
①其他条件一定时,n(H2O2 )∶n(Fe2+)的值对TOC 去除效果的影响如图1所示:
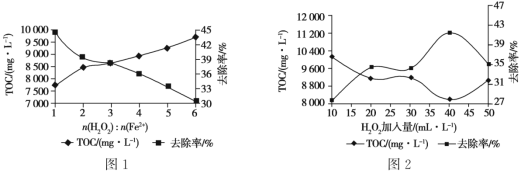
当TOC的去除率最大时,n(H2O2)∶n(Fe2+)=____。
②在pH=4.5,其他条件一定时,H2O2的加入量对TOC 去除效果的影响如图2所示,当H2O2的加入量大于40 mL·L-1时,TOC 去除率反而减小的原因是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A→C必须加热,否则会发生钝化现象。请回答下列问题:
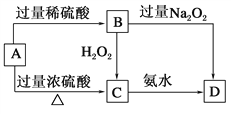
(1)A是________,你推断的理由是___________________。
(2)B在酸性条件下与H2O2反应的离子方程式:_____________________。
(3)A与过量浓H2SO4反应的化学方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊烯是生产精细化工产品的重要中间体,其工业制备原理如图1。以Pd/Al2O3为催化剂,在相同反应时间内,测得不同温度下(其他条件相同)环戊二烯转化率与环戊烯产率的变化曲线如图2。下列说法正确的是()
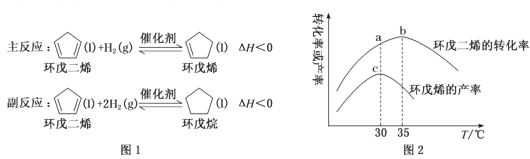
A.环戊二烯的转化率越大,越有利于环戊烯的生成
B.a点是主反应的平衡转化率,b点是副反应的平衡转化率
C.30℃~35℃之间环戊烯产率变化趋势与环戊二烯转化率不一致,原因是主反应被抑制,使环戊烯产率降低
D.30℃时催化剂的选择性最好,有利于提高生成环戊烯的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 取一定量固体溶解,向溶液中通入足量的CO,观察到有晶体析出 | 原固体中一定含Na2CO3 |
B | 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成 | 原固体中一定含有Na2CO3 |
C | 取一定量固体,溶解,向溶液中滴加适量AgNO3 溶液,观察有白色沉淀生成 | 原固体中一定含有NaCl |
D | 称取3.80g固体,加热至恒重,质量减少了0.620g。用足量稀盐酸溶解残留固体,充分反应后,收集到有0.88g气体 | 原固体中三种物质都有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有容积不同的X、Y两密闭容器,X中充满CO气体,Y中充满CH4、O2、N2的混合气体,同温同压下测得两容器中气体密度相同。下列叙述中不正确的是
A.Y容器中CH4、O2、N2的质量之比可以为1∶6∶3
B.Y容器中CH4、O2、N2的物质的量之比一定为1∶3∶6
C.两容器中所含气体分子数一定不同
D.两容器中所含气体的质量一定不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
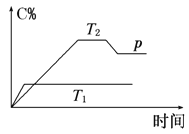
(1)温度T1________T2(填“大于”“等于”或“小于”)。
(2)正反应是________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m________2(填“大于”“等于”或“小于”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡___ _____移动(填“向正反应方向”“向逆反应方向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】塑料、橡胶等材料的交联剂E的合成路线如图所示:
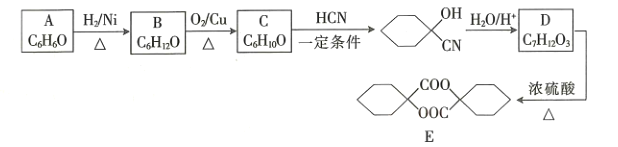
回答下列问题:
(1)B的名称为____________________。
(2)C生成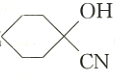 的反应类型是_________________,D中官能团的名称是________________。
的反应类型是_________________,D中官能团的名称是________________。
(3)D生成E的化学方程式为_____________________。
(4)E的同分异构体中符合下列条件的有______________种。(不考虑立体异构)
a.属于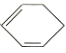 的二取代物
的二取代物
b.取代基处于对位且完全相同
c.能够与![]() 溶液反应产生
溶液反应产生![]()
其中核磁共振氢谱有4组峰,峰面积之比为6:2:1:1的结构简式为_______________。
(5)参照题干中合成路线,设计以丙酮为主要原料制备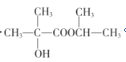 的合成路线______________(无机试剂任选)。
的合成路线______________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。

(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com