
【题目】焦亚硫酸钠(Na2S2O5)有广泛的用途,实验室中通过如下方法制备:
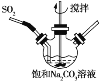
①不断搅拌条件下,在饱和Na2CO3溶液中缓缓通入SO2至反应完全;
②取下三颈烧瓶,测得反应液的pH=4.1;
③将溶液蒸发浓缩、结晶、过滤得焦亚硫酸钠晶体。
请回答下列问题:
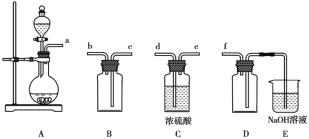
(1)实验室可利用Na2SO3和较浓的硫酸制备少量SO2气体,该反应的化学方程式为_______________。硫酸浓度太大不利于SO2气体逸出,原因是_____________。制备、收集干燥的SO2气体时,所需仪器如下。装置A是气体发生装置,按气流方向连接各仪器口,顺序为a→____→____→____→____→f。装置D的作用是__________。
(2)步骤①反应的离子方程式为________________,合成Na2S2O5的总化学方程式为__________________。
(3)在强碱性条件下利用Na2S2O5氧化HCOONa的方法可制备保险粉连二亚硫酸钠(Na2S2O4),反应的离子方程式为___________。
(4)工业上用焦亚硫酸钠法制备保险粉带来的主要问题是废水中含有大量的有机物,有机物总含碳量用TOC表征,常采用Fenton 氧化法去除废水中的有机物,即通过向废水中加入H2O2,以Fe2+作催化剂,产生具有强氧化性的羟基自由基(·OH)来氧化降解废水中的有机物。
①其他条件一定时,n(H2O2 )∶n(Fe2+)的值对TOC 去除效果的影响如图1所示:
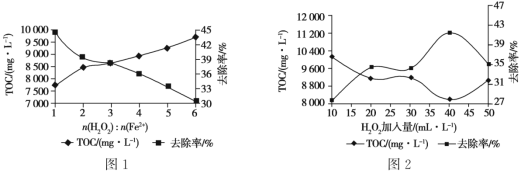
当TOC的去除率最大时,n(H2O2)∶n(Fe2+)=____。
②在pH=4.5,其他条件一定时,H2O2的加入量对TOC 去除效果的影响如图2所示,当H2O2的加入量大于40 mL·L-1时,TOC 去除率反而减小的原因是_______________________________________。
【答案】Na2SO3+H2SO4=Na2SO4+SO2↑+H2O 浓硫酸中只有少量H2SO4电离,c(H+)很小,导致复分解反应速率慢 d e c b 防止倒吸 CO32—+2SO2+H2O=2HSO3—+CO2 Na2CO3+2SO2=Na2S2O5+CO2 HCOO-+S2O52—+OH-= CO32—+ S2O42—+H2O 1 酸性条件下H2O2直接与Fe2+反应,导致溶液中羟基自由基(·OH)浓度减小,使得TOC去除率下降
【解析】
(1) 实验室用Na2SO3和硫酸制备少量SO2气体时,若硫酸浓度太大,则c(H+)较小,导致复分解反应速率慢,若硫酸浓度太小,则由于SO2气体易溶于水,也不利于SO2气体逸出;
收集SO2时,应先干燥,再收集——向上排空气法(长进短出);又因SO2易溶于水,要有防倒吸装置(安全装置);
(2) 反应终止时溶液的pH=4.1,可推测反应的产物是NaHSO3而不是Na2SO3,NaHSO3是弱酸的酸式盐,书写离子方程式时要注意拆分形式;起始原料是SO2和Na2CO3,目标产物是Na2S2O5,根据质量守恒可写出化学方程式;
(3) 书写该氧化还原反应方程式的关键是确定HCOONa的氧化产物,在强碱性条件下,HCOONa中+2价碳必被氧化为CO32—;
(4)①去除率最高时,TOC的含量最低,由图1可得此时n(H2O2)∶n(Fe2+)=1;
②当H2O2的加入量大于40 mL·L-1时,随着H2O2含量增加去除率反而降低,说明H2O2必参加了其他副反应。
(1)①亚硫酸钠和硫酸反应生成二氧化硫、硫酸钠和水,反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,故答案为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
②若硫酸浓度太大,主要以硫酸分子存在,溶液中c(H+)较小,导致复分解反应速率慢;若硫酸浓度太小,由于SO2气体易溶于水,不利于SO2气体逸出,故答案为浓硫酸中只有少量H2SO4电离,c(H+)很小,导致复分解反应速率慢;
③装置A用以制备二氧化硫气体、装置C用以干燥二氧化硫气体、装置B用向上排空气法收集比空气密度大的二氧化硫气体、装置D和E用以吸收二氧化硫气体,则按气流方向连接各仪器口,顺序为a→d→e→c→b→f;二氧化硫易溶于氢氧化钠溶液,D为安全瓶,可防止倒吸,故答案为d、e、c、b;防止倒吸;
(2)由反应终止时溶液的pH=4.1可知,步骤①为向Na2CO3过饱和溶液中通入SO2,发生反应生成NaHSO3和CO2,反应的离子方程式为2SO2+CO32-+H2O=2HSO3-+CO2,合成Na2S2O5的总反应为Na2CO3和SO2反应生成Na2S2O5和CO2反应的化学方程式为Na2CO3+2SO2═Na2S2O5+CO2,故答案为2SO2+CO32-+H2O=2HSO3-+CO2;Na2CO3+2SO2═Na2S2O5+CO2;
(3)由题给信息可知,Na2S2O5氧化HCOONa的方法可制备Na2S2O4时,S元素化合价由+4价降低为+3价,则在强碱性条件下,HCOONa中+2价碳必被氧化为CO32—,反应的离子方程式为:HCOO-+S2O52—+OH-= CO32—+ S2O42—+H2O,故答案为HCOO-+S2O52—+OH-= CO32—+ S2O42—+H2O;
(4)①去除率最高时,TOC的含量最低,由图1可得此时n(H2O2)∶n(Fe2+)=1,故答案为1;
②当H2O2的加入量大于40 mL·L-1时,随着H2O2含量增加去除率反而降低,说明酸性条件下H2O2直接与Fe2+反应,导致溶液中羟基自由基(·OH)浓度减小,使得TOC去除率下降,故答案为酸性条件下H2O2直接与Fe2+反应,导致溶液中羟基自由基(·OH)浓度减小,使得TOC去除率下降。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】成语是中国传统文化的瑰宝。铜墙铁壁、铜心铁胆、金戈铁马、百炼成钢等成语向人传递正能量。工业上,冶炼铁的有关热化学方程式如下:①C(s)+O2(g)=CO2(g) △H1=akJ·mol-1;②CO2(g)+C(s)=2CO(g) △H2=bkJ·mol-1;③Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H3=ckJ·mol-1;④2Fe2O3(s)+3C(s)=4Fe(s)+3CO2(g ) △H4=dkJ·mol-1(上述热化学方程式中,a,b,c,d均不等于0)下列说法正确的是
A. b<aB. CO(g)+ 1/2O2(g)= CO2(g) △H<akJ·mol-1
C. d=3c+2bD. C(s)+ 1/2O2(g)=CO (g) △H=(a+b)/2kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20. 00 mL 0.1 mol/L H2X溶液中滴入0.1 mo1/L NaOH溶液,溶液中由水电离出的c水(OH-) 的负对数[一lgc水(OH-)]即pOH水-与所加NaOH溶液体积的关系如图所示。下列说法中正确的是
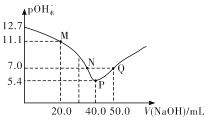
A.水的电离程度:M>PB.图中P点至Q点对应溶液中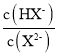 逐渐增大
逐渐增大
C.N点和Q点溶液的pH相同D.P点溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为不同温度下水的电离平衡曲线,已知pOH=lgc(OH),下列说法正确的是
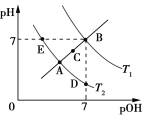
A. T1和T2的关系是:T1>T2
B. KW的关系是:B>C>A=D=E
C. A点到D点:加入少量酸可实现
D. T2时:pH=2的硫酸与pH=12的NaOH溶液等体积混合,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中FeCl3的水解反应已达平衡:FeCl3+3H2O![]() Fe(OH)3+3HCl,若要使FeCl3的水解程度增大,应该采用的方法是
Fe(OH)3+3HCl,若要使FeCl3的水解程度增大,应该采用的方法是
A. 加入NaHCO3B. 加入AgNO3固体
C. 加入FeCl3固体D. 降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温25℃时,下列溶液里微粒间物质的量浓度的关系中正确的是( ):
A. 浓度0.1mol/L的NH4HSO3溶液:c(NH4+)+ c(H+)= c(OH-)+ c(HSO3-)+ c(SO32-)
B. 等体积等浓度Na2S和NaHS混合液:c(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H+)
C. 将0.2mol/LNH3·H2O与0.1mol/LHCl等体积混合:c(Cl-)>c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
D. 在0.1mol/L的Na2CO3溶液中:c (OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对Al、Fe二种金属元素,下列说法正确的是
A. 铝能够稳定存在于空气中,而铁很容易生锈,说明铁比铝活泼
B. 等物质的量的Al、Fe分别与足量盐酸反应放出等质量的H2
C. 二者的氢氧化物都不可以通过氧化物化合反应直接制备
D. 二者的单质都能与强碱溶液反应生成H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用氧化锌矿粉(主要含ZnO、FeCO3、CuO等)制备碱式碳酸锌[Zn2(OH)2CO3],并将其用于合成氨工艺脱硫研究。
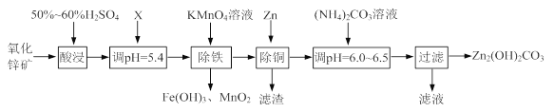
(1)“酸浸”时保持H2SO4过量的目的是_____。
(2)已知:Mn2+开始沉淀的pH=8.1。
①写出加入KMnO4溶液除铁的离子方程式:_____。
②流程中调节pH=5.4所加试剂X为_____(填化学式);试剂X、KMnO4溶液加入顺序能否互换?请判断并说明理由_____。
(3)上述流程中的“滤液”可以用作化肥,该滤液的主要成分为_____(填化学式)。
(4)合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素

(1)表格中最稳定的元素是_____(填元素符号),h在周期表的位置为_____。
(2)元素i的最高价氧化物对应水化物的化学式为_____
(3)c、d、e三种元素对应的原子半径由大到小的顺序为_____(用元素符号表示)
(4)c、h气态氢化物的稳定性强弱关系是_____(用化学式表示)
(5)写出f和i形成的化合物中所含化学键的类型_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com