
【题目】如图为不同温度下水的电离平衡曲线,已知pOH=lgc(OH),下列说法正确的是
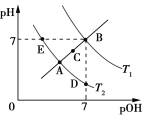
A. T1和T2的关系是:T1>T2
B. KW的关系是:B>C>A=D=E
C. A点到D点:加入少量酸可实现
D. T2时:pH=2的硫酸与pH=12的NaOH溶液等体积混合,溶液呈中性
【答案】C
【解析】
A.水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大,根据图片知,Kw中A>B,则T1<T2,故A错误;
B.相同温度下,水的离子积常数相同,温度越高,水的离子积常数越大,根据图片知,离子积常数A=E=D>C>B,故B错误;
C.A点到D点是等温线,离子积常数不变,溶液的碱性减弱、酸性增强,所以A点到D点:加入少量酸可实现,故C正确;
D.水的离子积常数未知,无法计算NaOH中氢氧根离子浓度,等体积混合,酸中氢离子、碱中氢氧根离子物质的量不一定相等,溶液酸碱性无法判断,如果是常温下,pH=2的硫酸与pH=12的NaOH溶液等体枳混合,溶液呈中性,故D错误;
故答案为C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】中国科学家孙予罕等发现,以泡沫镍[3 NiO/Ni(3 表示 NiO 在泡沫镍中的质量百分数)] 作为基材上的催化剂可实现将烷烃直接电催化转化为醇类(转化示意图如图所示)。下列说法正确的是
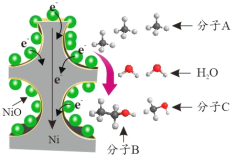
A.22.4 L A 中质子数为 10 mol
B.1mol C 中共价键数目为 4 mol
C.生成 1 mol Ni 可还原出 1 mol B
D.11.8 g 泡沫镍含 Ni 单质 0.194 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法错误的是( )

A.通入CH4的一端为原电池的负极,通入空气的一端为原电池的正极
B.0<V≤22.4 L时,电池总反应的化学方程式为CH4+2O2+2KOH=K2CO3+3H2O
C.22.4 L<V≤44.8 L时,负极电极反应为CH4-8e-+![]() +3H2O=
+3H2O=![]()
D.V=33.6 L时,溶液中只存在阴离子![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国矿石种类很多,如黄铜矿、煤、锰矿、锑锌矿等,请回答下列问题:
(l)黄铜矿的主要成分为二硫化亚铁铜(CuFeS2),基态Cu2+的外围电子排布图为 ______,Fe2+含有 ___个未成对电子。
(2)Mn的第三电离能比Fe的第三电离能大的原因为 ___。
(3)煤化工可得氨气、苯、甲苯等产品,氨的空间构型为 ___,甲苯分子上甲基的碳原子的杂化方式为____;氨硼烷化合物(NH3BH3)是一种新型化学氢化物储氢材料,氨硼烷的结构式为____(配位键用“→”表示),与氨硼烷互为等电子体的有机小分子为_____写名称)。
(4)碲化锌的晶胞结构如图1所示。
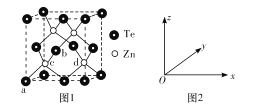
①碲化锌的化学式为____。
②图2可表示晶胞内部各原子的相对位置,已知a、b、c的原子坐标参数分别为(0,0,0)、(![]() ,0,
,0,![]() )、(
)、(![]() ,
,![]() ,
,![]() ),则d的原子坐标参数为____
),则d的原子坐标参数为____
③若两个距离最近的Te原子间距离为apm,阿伏加德罗常数值为NA,则晶体密度为____g/cm3(用含有NA、a的代数式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅是一种化工原料,可以制备一系列物质。下列说法正确的是( )
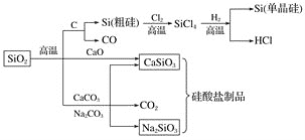
A.图中所有反应都不属于氧化还原反应
B.硅酸盐的化学性质稳定,常用于制造光导纤维
C.可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如下图所示(不考虑C2O42-的水解)。下列叙述正确的是
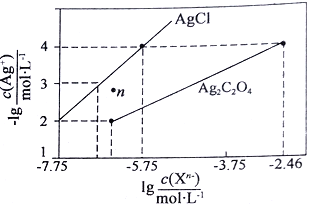
A.Ksp(Ag2C2O4)的数量级等于10-7
B.n点表示AgCl的不饱和溶液
C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4 沉淀
D.Ag2C2O4+2C1-=2AgCl+C2O42-的平衡常数为109.04
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)有广泛的用途,实验室中通过如下方法制备:
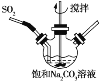
①不断搅拌条件下,在饱和Na2CO3溶液中缓缓通入SO2至反应完全;
②取下三颈烧瓶,测得反应液的pH=4.1;
③将溶液蒸发浓缩、结晶、过滤得焦亚硫酸钠晶体。
请回答下列问题:
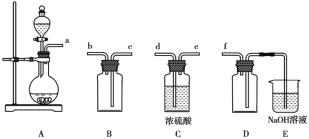
(1)实验室可利用Na2SO3和较浓的硫酸制备少量SO2气体,该反应的化学方程式为_______________。硫酸浓度太大不利于SO2气体逸出,原因是_____________。制备、收集干燥的SO2气体时,所需仪器如下。装置A是气体发生装置,按气流方向连接各仪器口,顺序为a→____→____→____→____→f。装置D的作用是__________。
(2)步骤①反应的离子方程式为________________,合成Na2S2O5的总化学方程式为__________________。
(3)在强碱性条件下利用Na2S2O5氧化HCOONa的方法可制备保险粉连二亚硫酸钠(Na2S2O4),反应的离子方程式为___________。
(4)工业上用焦亚硫酸钠法制备保险粉带来的主要问题是废水中含有大量的有机物,有机物总含碳量用TOC表征,常采用Fenton 氧化法去除废水中的有机物,即通过向废水中加入H2O2,以Fe2+作催化剂,产生具有强氧化性的羟基自由基(·OH)来氧化降解废水中的有机物。
①其他条件一定时,n(H2O2 )∶n(Fe2+)的值对TOC 去除效果的影响如图1所示:
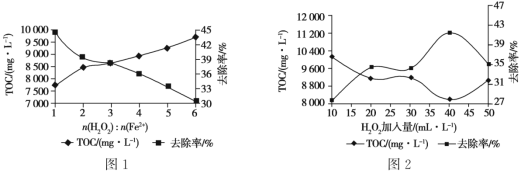
当TOC的去除率最大时,n(H2O2)∶n(Fe2+)=____。
②在pH=4.5,其他条件一定时,H2O2的加入量对TOC 去除效果的影响如图2所示,当H2O2的加入量大于40 mL·L-1时,TOC 去除率反而减小的原因是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.马口铁(镀锡铁皮)镀层破损后铁仍不易腐蚀
B.CH3Cl(g)+Cl2(g)![]() CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0
CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0
C.MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)< Ksp(MnS)
D.合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊烯是生产精细化工产品的重要中间体,其工业制备原理如图1。以Pd/Al2O3为催化剂,在相同反应时间内,测得不同温度下(其他条件相同)环戊二烯转化率与环戊烯产率的变化曲线如图2。下列说法正确的是()
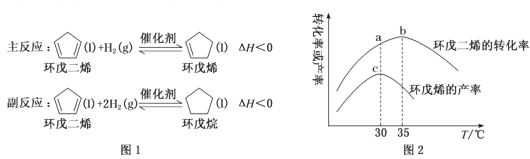
A.环戊二烯的转化率越大,越有利于环戊烯的生成
B.a点是主反应的平衡转化率,b点是副反应的平衡转化率
C.30℃~35℃之间环戊烯产率变化趋势与环戊二烯转化率不一致,原因是主反应被抑制,使环戊烯产率降低
D.30℃时催化剂的选择性最好,有利于提高生成环戊烯的平衡转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com