
【题目】二氧化硅是一种化工原料,可以制备一系列物质。下列说法正确的是( )
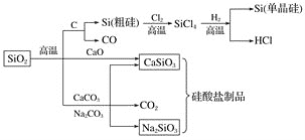
A.图中所有反应都不属于氧化还原反应
B.硅酸盐的化学性质稳定,常用于制造光导纤维
C.可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
科目:高中化学 来源: 题型:
【题目】近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题。雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成。
(1)机动车的尾气是雾霾形成的原因之一,近几年有人提出利用选择性催化剂让汽油中挥发出来的C3H6催化还原尾气中的NO气体,请写出该过程的化学方程式:__________
(2)到了冬季,我国北方烧煤供暖所产生的废气也是雾霾的主要来源之一。经研究发现将煤炭在O2/CO2的气氛下燃烧,发现能够降低燃煤时NO的排放,主要反应为:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH
若① N2(g)+O2(g)![]() 2NO(g) ΔH1= +180.5 kJmol-1
2NO(g) ΔH1= +180.5 kJmol-1
② CO(g)![]() C(s)+1/2O2(g) ΔH2= +110.5 kJmol-1
C(s)+1/2O2(g) ΔH2= +110.5 kJmol-1
③ C (s)+O2(g)![]() CO2(g) ΔH3= -393.5 kJmol-1
CO2(g) ΔH3= -393.5 kJmol-1
则ΔH=_____________kJmol-1。
(3)燃煤尾气中的SO2用NaOH溶液吸收形成NaHSO3溶液,在pH为4~7之间时电解,硫元素在铅阴极上被电解还原为Na2S2O4。Na2S2O4俗称保险粉,广泛应用于染料、印染、造纸、食品工业以及医学上。这种技术是最初的电化学脱硫技术之一。请写出该电解反应中阴极的电极方程式:______________________________________。
(4)SO2经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g) +O2(g)![]() 2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
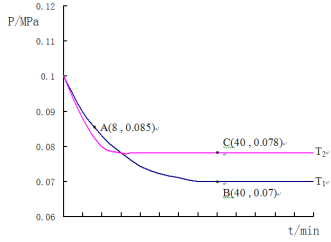
①该反应的化学平衡常数表达式:K=__________________。
②图中A点时,SO2的转化率为________________
③计算SO2催化氧化反应在图中B点的压强平衡常数K=_______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
④若在T2℃,其他条件不变的情况下测得压强的变化曲线如图所示,则T1____T2(填“>”、“<”、“=”);其中C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正) ____vA(逆) (填“>”、“<”、“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。请回答:

(1)实验室制取氨气的化学方程式是____。
(2)如图一是进行氨气喷泉实验的装置,引发喷泉后氨气使烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)____。
(3)该小组同学设计了如图二所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。
①实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式___。
②碱石灰的作用是________。
③该装置存在明显缺陷,请指出存在的问题______。
Ⅱ.3.2g Cu与30mL,8mol/L过量HNO3反应,硝酸的还原产物为NO,NO2,反应后溶液中所含H+为a mol,则:①此时溶液中所含的NO![]() 为_____ mol。
为_____ mol。
②所生成的NO在标准状况下体积为_______L。(以上结果均用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g)+yB(?) ![]() zC(g);平衡时测得A的浓度为0.45 mol/L,保持温度不变,将容器的容积压缩到原来的一半,再达平衡时,测得A的浓度增大为0.9 mol/L。下列有关判断正确的是
zC(g);平衡时测得A的浓度为0.45 mol/L,保持温度不变,将容器的容积压缩到原来的一半,再达平衡时,测得A的浓度增大为0.9 mol/L。下列有关判断正确的是
A. 各物质的计量数一定满足:x+y=z
B. 若B为气体,压缩后B的体积分数增大,转化率降低
C. 无论B为固体或气体,压缩后B的质量都不会改变
D. 压缩时,平衡向逆反应方向移动,且正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。

1、测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH="2" MnO(OH)2↓
酸性条件下,MnO(OH)2将I氧化为I2:②MnO(OH)2+I+H+→Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2:③2S2O32+I2=S4O62+2I
2、测定步骤
a.安装装置,检验气密性,充N2排尽空气后,停止充N2。
b.向烧瓶中加入200mL水样。
c.向烧瓶中依次迅速加入1mLMnSO4无氧溶液(过量)、2mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d搅拌并向烧瓶中加入2mL硫酸无氧溶液至反应②完全,溶液为中性或弱酸性。
e.从烧瓶中取出40.00mL溶液,以淀粉作指示剂,用0.01000mol/L Na2S2O3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)配置以上无氧溶液时,除去所用溶剂水中氧的简单操作为__________。
(2)在橡胶塞处加入水样及有关试剂应选择的仪器为__________。
①滴定管②注射器③量筒
(3)搅拌的作用是__________。
(4)配平反应②的方程式,其化学计量数依次为__________。
(5)步骤f为__________。
(6)步骤e中达到滴定终点的标志为__________。若某次滴定消耗Na2S2O3溶液4.50mL,水样的DO=__________mg/L(保留一位小数)。作为饮用水源,此次测得DO是否达标:__________(填“是”或“否”)
(7)步骤d中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用如图装置模拟在A池中实现铁上镀铜,在C装置中实现工业KCl制取KOH溶液。
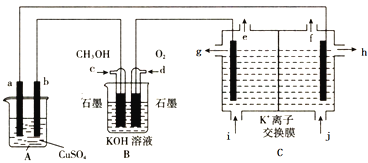
下列有关说法错误的是
A. a为精铜,b为铁制品可实现镀铜要求
B. c为负极,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O
C. 从e出来的气体为氧气,从f出来的气体为氢气
D. 钾离子从电解槽左室向右室迁移,h口出来的为高浓度的KOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象推出相应结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 某溶液中加入Ba(NO3)2溶液,再加足量盐酸 | 先有白色沉淀生成,加盐酸后白色沉淀不消失 | 原溶液中有SO42- |
B | 将湿润的淀粉碘化钾试纸放在盛有红棕色气体的集气瓶口 | 试纸变蓝 | 红棕色气体为溴蒸气 |
C | 将碳酸钠与盐酸反应产生的气体通入盛有硅酸钠溶液的烧杯中 | 烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
D | 将0.1mol/LMgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液 | 先有白色沉淀生成,后转变为蓝色沉淀 | 溶解度:Cu(OH)2<Mg(OH)2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以绕键轴自由旋转,结构简式为: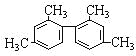 的烃,下列说法正确的是( )
的烃,下列说法正确的是( )
A.分子中至少有9个碳原子处于同一平面上
B.分子中至少有11个碳原子处于同一平面上
C.分子中至少有16个碳原子处于同一平面上
D.该烃属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑩十种元素在周期表中的位置:
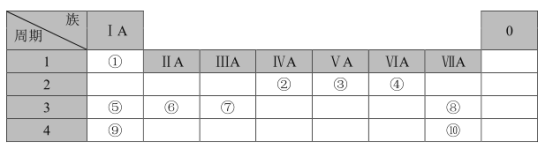
请按要求回答下列问题:
(1)元素⑤的原子结构示意图为___;元素②的最高价氧化物的电子式是___。
(2)⑤、⑥、⑨三种元素原子半径由大到小的顺序是___(填元素符号);这三种元素最高价氧化物对应水化物中碱性最强的是___(填化学式)。
(3)③、④元素的简单氢化物的稳定性较弱的是___(填化学式)。
(4)①、②、④三种元素形成的有机物的分子结构模型如图所示,写出该有机物的结构简式:___;①与②所形成的最简单的烯烃与溴的四氯化碳溶液反应的化学方程式:___。

(5)元素⑦的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式:___。
(6)写出元素⑨的单质与水反应的化学方程式:___。
(7)请从原子结构的角度解释,元素⑧非金属性比元素⑩强的原因:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com