
【题目】工业上采用如图装置模拟在A池中实现铁上镀铜,在C装置中实现工业KCl制取KOH溶液。
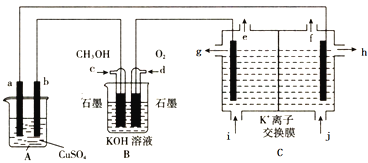
下列有关说法错误的是
A. a为精铜,b为铁制品可实现镀铜要求
B. c为负极,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O
C. 从e出来的气体为氧气,从f出来的气体为氢气
D. 钾离子从电解槽左室向右室迁移,h口出来的为高浓度的KOH溶液
【答案】C
【解析】
根据图像可知,B为原电池,氧气得电子与水反应生成氢氧根离子,d作电池的正极;c上甲醇失电子,与氢氧根离子反应生成碳酸根离子和水;A、C为电解池g、a为电解池的阳极,b、h为电解池的阴极;
A. a为精铜,作电解池的阳极,失电子,b为铁制品作阴极,铜离子得电子可实现镀铜要求,A正确;
B. c为负极,甲醇失电子与溶液中的氢氧根离子反应生成碳酸根离子,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,B正确;
C. 电解KCl,e处为阳极,氯离子失电子出来的气体为氯气,从f出来的气体为氢气,C错误;
D. 电解槽左侧为阳极室,钾离子从电解槽左室向右室迁移,h口出来的为高浓度的KOH溶液,D正确;
答案为C


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源: 题型:
【题目】CoCl2可用于电镀,是一种性能优越的电池前驱材料,由含钴矿(Co元素主要以Co2O3、CoO存在,还含有Fe、Si、Cu、Zn、Mn、Ni、Mg、Ca元素)制取氯化钴晶体的一种工艺流程如下:

已知:①焦亚硫酸钠Na2S2O5,常做食品抗氧化剂。CaF2、MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
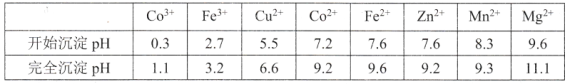
回答下列问题:
(1)操作①的名称为_________,NaClO3具有氧化性,其名称为__________________。
(2)浸取中加入Na2S2O5的作用是___________________________。
(3)滤液1中加入NaClO3的作用是_________,相关的离子方程式为__________________。
(4)加入Na2CO3溶液生成滤渣2的主要离子方程式为___________________________。
(5)滤渣3主要成分为__________________(写化学式)。滤液3经过多次萃取与反萃取制备CoCl2晶体
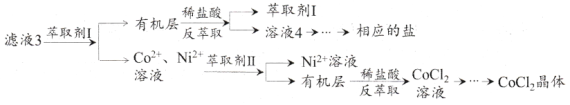
(6)滤液3中加入萃取剂I,然后用稀盐酸反萃取的目的是___________________________。
(7)制备晶体CoCl2·6H2O,需在减压环境下烘干的原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①铅蓄电池总反应为: Pb(s) + PbO2(s) + 2H2SO4(aq) ![]() 2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)
②电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。
下列关于电池的叙述正确的是
A.充电电池的化学反应原理是氧化还原反应
B.铅蓄电池可以无限制地反复放电、充电,不会造成环境污染
C.铅蓄电池比锂电池的理论比能量高
D.铅蓄电池正极电极反应为:PbO2 +4H+ +2e— = Pb2+ +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验过程证明了海带中存在碘元素:

下列说法不正确的是
A. 步骤①需要将干海带放入蒸发皿中灼烧
B. 步骤②中发生反应的离子方程式为2I-+2H++H2O2=I2+2H2O
C. 步骤③操作后,观察到试管中的溶液变为蓝色,则可说明海带中含有碘元素
D. 若步骤②仅滴加稀硫酸后通入氧气,则步骤③操作后,试管中的溶液也变成蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应的离子方程式对应且正确的是 ( )
A. 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓
B. 用醋酸除去水垢:CaCO3 + 2H+=Ca2+ + H2O + CO2↑
C. 苯酚与纯碱溶液混合:2C6H5OH + CO32- ![]() CO2 ↑+ H2O + 2C6H5O-
CO2 ↑+ H2O + 2C6H5O-
D. 甲醛溶液与足量的银氨溶液共热:HCHO+4Ag(NH3)2++4OH-![]() CO32-+2NH4++4Ag↓+6NH3+2H2O
CO32-+2NH4++4Ag↓+6NH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸的结构如图所示,关于咖啡酸的描述不正确的是( )
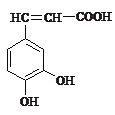
A. 分子式为C9H8O4
B. 1mol咖啡酸最多能与4mol氢气发生加成反应
C. 遇浓溴水,既能发生取代反应又能发生加成反应
D. 1mol咖啡酸最多能与3mol碳酸氢钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L的密闭容器中,X、Y、Z三种气体随时间变化的曲线如图所示。
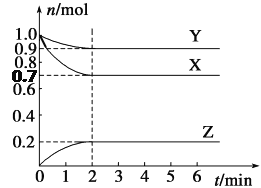
请回答下列问题:
(1)由图中数据分析:该反应的化学方程式为__________________________。
(2)反应开始至2 min,Z的平均反应速率为________。
(3)5 min时Z的生成速率与6 min时Z的生成速率相比较,前者________后者(填“大于”、“小于”或“等于”)。
(4)上述反应过程中,如果降低温度,则其反应速率________(填“增大”、“减小”或“不变)。如果使用合适的催化剂,则其反应速率________ (填“增大”、“减小”或“不变)。
(5)下列各项中不可以说明上述反应达到平衡的是________(填字母)。
a.混合气体的密度不变
b.混合气体的压强不变
c.同一物质的正反应速率等于逆反应速率
d.X的浓度保持不变
e.生成1 mol Z和同时生成1.5 mol X
f.X、Y、Z的反应速率之比为3∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示,下列分析合理的是
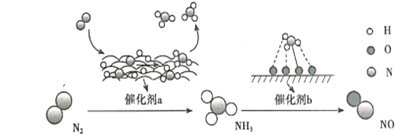
A. 催化剂a表面发生了极性共价键的断裂和形成
B. 在催化剂b表面形成氮氧键时,不涉及电子转移
C. N2与H2反应生成NH3的原子利用率为100%
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法不正确的是
)是最简单的一种。下列关于该化合物的说法不正确的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过四种(不考虑空间异构)
C. 所有碳原子均处同一平面
D. 由该物质生成1 mol C5H12需要2 mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com