
【题目】在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
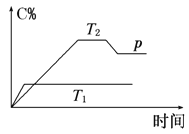
(1)温度T1________T2(填“大于”“等于”或“小于”)。
(2)正反应是________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m________2(填“大于”“等于”或“小于”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡___ _____移动(填“向正反应方向”“向逆反应方向”或“不”)。
科目:高中化学 来源: 题型:
【题目】在同体积0.3 mol·L-1的H2SO4、HCl、HNO3、CH3COOH溶液中,加入足量的Zn,下列说法中正确的是
A.硫酸中放出氢气量最多 B.醋酸中放出氢气量最多
C.盐酸中放出的氢气量最多 D.只有盐酸和硝酸中放出的氢气量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下的化学反应CO2(g)+H2(g) ![]() CO(g)+H2O(g),K为此反应化学平衡常数,其中K和温度的关系如下表:
CO(g)+H2O(g),K为此反应化学平衡常数,其中K和温度的关系如下表:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
根据以上信息推断以下说法正确的是( )
A. 此反应为放热反应
B. 此反应只有达到平衡时,密闭容器中的压强才不会变化
C. 温度升高H2的体积分数减小
D. 该反应的化学平衡常数越大,反应物的转化率越低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料,已知A在标准状况下的密度为1.25g·L-1,D是塑料的主要成分,据此回答下列有关问题:

(1)A的结构简式为__________。
(2)反应⑤的反应类型为__________。
(3)反应⑥的方程式为__________。
(4)下列说法不正确的是__________。
A.通过石蜡油的裂化可以得到多种A的同系物,如丙烯
B.反应⑨的条件是氯气、光照
C.反应⑦的反应类型为消去反应
D.反应④为加聚反应,得到的产物可使酸性高锰酸钾溶液褪色
E.得到C有多种途径,通过途径⑧⑨得到C,产率较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃某二元碱B(OH)2水溶液中,B2+、B(OH)+和B(OH)2三者各自的物质的量分数δ随溶液pH的变化曲线如图所示,下列说法错误的是(已知多元碱的电离是逐级进行的)
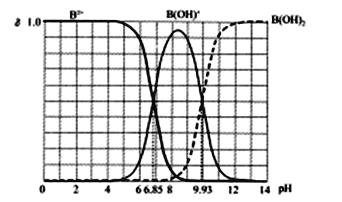
A. Kb2[B(OH)2]的数量级为10-8
B. 在B(OH)Cl溶液中c(OH-)>c(H+)
C. 等物质的量的BCl2和B(OH)Cl混合溶液中δ(B2+)<δ[B(OH)+]
D. B(OH)Cl溶液中,若c[B(OH)2]+2c(B2+)+c(H+)-c(OH-),则δ[B(OH)2]=δ[B(OH)+]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨做电极电解CuCl2溶液,下列说法正确的是( )
A. 在阳极上析出金属铜 B. 在阴极上析出金属铜
C. 在阴极上产生有刺激性气味的气体 D. 阳极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中,不符合生产实际的是( )
A. 电解MgCl2溶液获取金属镁,用石墨作阳极
B. 电解法精炼粗铜,用纯铜作阴极
C. 电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D. 在镀件上电镀锌,用锌作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。
该小组设计的简易实验装置如图所示:
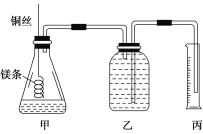
该实验的主要操作步骤如下:
①配制100 mL 1.0 mol/L的盐酸溶液;
②用________(填仪器名称并注明规格)量取10.0 mL 1.0 mol/L的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题。
(1)用文字表述实验步骤④中检查装置气密性的方法:
___________________________________________________
(2)实验步骤⑤中应选用________(填序号)的量筒。
A.100 mol B.200 mL C.500 mL
读数时除恢复到室温外,还要注意_________________________________________。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=________,若未除去镁条表面的氧化膜,则测量结果________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有下列反应:
①2H2O+Cl2+SO2===H2SO4+2HCl
②2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O
根据上述两个反应回答:
(1)Cl2、KMnO4、H2SO4三者氧化性强弱顺序为______________,Cl-、SO2、Mn2+三者还原性强弱顺序为___________。
(2)反应①中氧化产物和还原产物的质量之比为________。
(3)反应②中浓盐酸表现出的性质是________。
A.还原性 B.酸性 C.氧化性
(4)用双线桥法标出反应②电子转移的方向和数目_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com