
【题目】在一定体积的密闭容器中,进行如下的化学反应CO2(g)+H2(g) ![]() CO(g)+H2O(g),K为此反应化学平衡常数,其中K和温度的关系如下表:
CO(g)+H2O(g),K为此反应化学平衡常数,其中K和温度的关系如下表:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
根据以上信息推断以下说法正确的是( )
A. 此反应为放热反应
B. 此反应只有达到平衡时,密闭容器中的压强才不会变化
C. 温度升高H2的体积分数减小
D. 该反应的化学平衡常数越大,反应物的转化率越低
科目:高中化学 来源: 题型:
【题目】已知H2(g)+I2(g)![]() 2HI(g)ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是
2HI(g)ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是
A. 甲、乙提高相同温度 B. 甲中加入0.1molHe,乙中不变
C. 甲降低温度,乙增大压强 D. 甲增加0.1molH2,乙增加0.1molI2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Kb=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分別加蒸馏水稀释,pH随溶液体积的变化如图所示,下列叙述正确的是( )
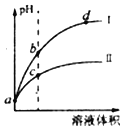
A. 曲线Ⅰ为次氯酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗氢氟酸的体积较小
C. b点溶液中水的电离程度比c点溶液中水的电离程度小
D. 从b点到d点,溶液中![]() 保持不变(HR代表HClO或HF)
保持不变(HR代表HClO或HF)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬(Ⅵ)的化合物有较大毒性,如不回收利用,会对环境造成污染。某混合浆液含Al(OH)3、MnO2和少量Na2CrO4。某研究小组设计了如下电解分离装置,可以使浆液较完全地分离成固体混合物和含铬元素溶液,并回收利用。下列说法错误的是( )
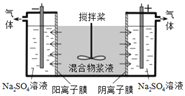
A. 通电后CrO42-将通过阴离子膜进入阳极室 B. 阴极室最终只能得到Na2SO4和H2
C. 阳极的电极反应式为:4OH--4e-=O2↑+2H2O D. 分离后所得含铬元素的粒子有CrO42-和Cr2O72-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为使空气质量达标,完成二氧化硫、氮氧化物排放量下降的目标,离不开各种化学处理方法。
(1)一定条件下,用CO处理燃煤烟气中的SO2可生成液态硫,实现硫的回收。
己知:2CO(g)+O2(g)![]() 2CO2(g)△H=-566kJ·mol-1
2CO2(g)△H=-566kJ·mol-1
S(l)+O2(g)![]() SO2(g)△H=-296kJ·mol-1
SO2(g)△H=-296kJ·mol-1
则用CO处理燃煤烟气中SO2的热化学方程式是__________________________________,该反应的平衡常数表达式为K=_________________________。
(2)研究发现利用反应4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)可消除NO的污染。当NH3与NO的物质的量之比分别为1∶3、3∶1和4∶1时;NO脱除率随温度变化的曲线如图所示,则:
4N2(g)+6H2O(g)可消除NO的污染。当NH3与NO的物质的量之比分别为1∶3、3∶1和4∶1时;NO脱除率随温度变化的曲线如图所示,则:
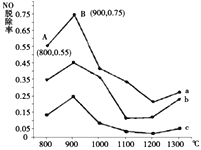
①一定温度下密闭的恒压容器中,能表示上述反应达到化学平衡状态的是___________(填字母)。
a.4v逆(N2)=v正(O2)
b.混合气体的密度保持不变
c.c(N2)∶c(H2O)∶c(NH3)=4∶6∶4
d.单位时间内断裂12molN-H键的同时断裂4molN≡N键
②曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_______mg/(m3·s)。
③曲线b对应的NH3与NO的物质的量之比是___________,做出该判断的理由是___________。
(3)采用NaClO2溶液作为吸收剂可同时进行脱硫、脱硝的处理。已知,温度为323K时,在浓度为5×10-3mol·L-1的NaClO2溶液中通入含有SO2和NO的混合气,反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c/(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
则NaClO2溶液脱硝过程中主要反应的离子方程式为_______________________________;增大压强,NO的转化率__________(填“提高”、“不变"或“降低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。请回答下列问题:
![]()
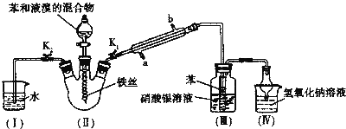
(1)冷凝管所起的作用为冷凝回流和导气,冷凝水从______口进入(填“a或“b”)。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。 Ⅲ中小试管内苯的作用是_____。能说明苯与液溴发生了取代反应的现象是_____。Ⅳ中球形干燥管的作用是_____。
(3)待三颈烧瓶中的反应进行到仍有气泡冒出时,关闭分液漏斗活塞,再_____,这样操作的目的是_____。(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中有0.2mol XO4﹣ , 加入0.3mol Na2SO3恰好反应,已知Na2SO3被氧化成Na2SO4 , 则还原产物中X的化合价为( )
A.0
B.+1
C.+3
D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
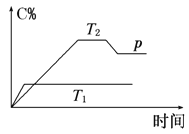
(1)温度T1________T2(填“大于”“等于”或“小于”)。
(2)正反应是________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m________2(填“大于”“等于”或“小于”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡___ _____移动(填“向正反应方向”“向逆反应方向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO、H2和O2组成的混和气体60mL,在一定条件下恰好完全反应,测得生成物在101kPa120℃下对氢气的相对密度为18.75,则原混和气体中H2所占的体积分数为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com