
����Ŀ��ʵ������һ����ɫ���壬���ܺ���Na2CO3��NaHCO3��NaCl�е�һ�ֻ���֡����и���ʵ����ʵ�ó��Ľ�����ȷ���ǣ�������
ѡ�� | ʵ����������� | ���� |
A | ȡһ���������ܽ⣬����Һ��ͨ��������CO���۲쵽�о������� | ԭ������һ����Na2CO3 |
B | ȡһ�������壬�ܽ⣬����Һ�м�������CaO��ĩ����ַ�Ӧ��۲쵽�а�ɫ�������� | ԭ������һ������Na2CO3 |
C | ȡһ�������壬�ܽ⣬����Һ�еμ�����AgNO3 ��Һ���۲��а�ɫ�������� | ԭ������һ������NaCl |
D | ��ȡ3.80g���壬���������أ�����������0.620g��������ϡ�����ܽ�������壬��ַ�Ӧ���ռ�����0.88g���� | ԭ�������������ʶ��� |
A.AB.BC.CD.D
���𰸡�D
��������
A��Na2CO3��NaHCO3��NaCl����CO����Ӧ��
B������Һ�м�������CaO��ĩ����Na2CO3��NaHCO3��Ӧ���ɰ�ɫ������
C��Na2CO3��NaCl������������Ӧ���ɰ�ɫ������
D����ȡ3.80g���壬���������أ�����������0.620g��һ����̼�����ƣ�����ϡ�����ܽ�������壬��ַ�Ӧ���ռ�����0.88g���壬��֪̼���������ᷴӦ��
A��Na2CO3��NaHCO3��NaCl����CO����Ӧ�������о�����������A����
B������Һ�м�������CaO��ĩ����Na2CO3��NaHCO3��Ӧ���ɰ�ɫ����������ȷ���Ƿ�Na2CO3����B����
C��Na2CO3��NaCl������������Ӧ���ɰ�ɫ����������ȷ���Ƿ�NaCl����C����
D����ȡ3.80g���壬���������أ�����������0.620g��һ����̼������Ϊ![]() ��2��84g/mol��1.62g��������̼����Ϊ0.01mol��
��2��84g/mol��1.62g��������̼����Ϊ0.01mol��![]() ��106g/mol��0.53g������ϡ�����ܽ�������壬��ַ�Ӧ���ռ�����0.88g���壬��֪̼����Ϊ
��106g/mol��0.53g������ϡ�����ܽ�������壬��ַ�Ӧ���ռ�����0.88g���壬��֪̼����Ϊ![]() ��106g/mol��2.12g��ԭ����ﺬ̼����Ϊ2.12g��1.62g��0.5g����NaClΪ3.80g��1.62g��0.5g��1.68g����D��ȷ��
��106g/mol��2.12g��ԭ����ﺬ̼����Ϊ2.12g��1.62g��0.5g����NaClΪ3.80g��1.62g��0.5g��1.68g����D��ȷ��
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��FeCl3��ˮ�ⷴӦ�Ѵ�ƽ�⣺FeCl3��3H2O![]() Fe(OH)3��3HCl����ҪʹFeCl3��ˮ��̶�����Ӧ�ò��õķ�����
Fe(OH)3��3HCl����ҪʹFeCl3��ˮ��̶�����Ӧ�ò��õķ�����
A. ����NaHCO3B. ����AgNO3����
C. ����FeCl3����D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��̵Ļ�ѧ���������ȷ����
A. ������ͭ��Һ��ȥ��Ȳ�е��������壺H2S + Cu2+=== CuS�� + 2H+
B. ���Ȼ�����Һ�е��������ˮ��Al3+ + 4OH- === AlO2- + 2H2O
C. �õ���ʽ��ʾNa��Cl�γ�NaCl�Ĺ��̣�![]()
D. ���������绯ѧ��ʴ��������Ӧ��Fe-3e- === Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؽ����Ĺ�ҵ�Ʒ�����ȷ���ǣ�������
A.�������õ���Ȼ�����Һ�ķ�����õ�����
B.���ѣ��ý������û��������Ȼ��ѣ�TiCl4���е���
C.���ƣ��ú�ˮΪԭ���Ƶþ��Σ��ٵ�ⴿ����NaCl��Һ
D.�������ý�̿�Ϳ�����Ӧ������CO�ڸ����»�ԭ����ʯ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶���,��ij�ܱ������м���0.2 mol CO��0.2 mol H2O,������ӦCO��g��+H2O��g��![]() CO2��g��+H2��g��,4 minʱ��Ӧ�ﵽƽ��״̬,���n��CO����n��CO2��=3��2,����˵����ȷ����
CO2��g��+H2��g��,4 minʱ��Ӧ�ﵽƽ��״̬,���n��CO����n��CO2��=3��2,����˵����ȷ����
A.��С���������,���������ܶȲ���
B.v��CO��=v��CO2��ʱ,������Ӧ�ﵽƽ��״̬
C.ƽ��ʱCO��H2O��ת�������
D.������������·�Ӧ�Ļ�ѧƽ�ⳣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣�����������ĸ�ֱ����ijһ��ѧԪ��

��1�����������ȶ���Ԫ����_____����Ԫ�ط��ţ���h�����ڱ���λ��Ϊ_____��
��2��Ԫ��i������������Ӧˮ����Ļ�ѧʽΪ_____
��3��c��d��e����Ԫ�ض�Ӧ��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ_____����Ԫ�ط��ű�ʾ��
��4��c��h��̬�⻯����ȶ���ǿ����ϵ��_____���û�ѧʽ��ʾ��
��5��д��f��i�γɵĻ�������������ѧ��������_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ���������ƾ�����Fe2(OH)6-2n(SO4)n]m�㷺��������ˮ�ȵľ�����ij��������������ͭ��Һ�Ʊ����������������£�

�ش��������⣺
��1���Լ�AΪ__________��
��2����ʵ�������μ������ᣬ����������Ũ����ʱ����ϡ���ᣬ������������ˮ�⣬��Ϊ��_______�����ۺ���ʱ��������Ϊ�˿�����Һ��pH��һ����Χ�ڣ���pHƫ����_________��
��3��������������ʱѡ����ɫ������˫��ˮ���ù�����Ҫ���µ�ԭ����________��
��4����ѹ����װ����ͼ��ʾ��ʵ�鿪ʼʱ��Ӧ�ȴ�ѹ�ã���_____������ĸ����ͨ����ˮ���ٴ���ת������ʵ�����ʱӦ�ȹر���ת��������_______������aͨ���������ȡ��______�����������ƣ������л�þ�������ʵ���ȡ��ѹ������������___________��
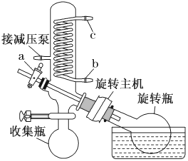
��5���ⶨ�ۺ���������Ʒ��Ҫ�ɷֵĻ�ѧʽ��ȷ��ȡ���þ�����Ʒ5.520g����������ϡ�����У�Ȼ��ֳ����ȷݣ�
a.һ�ݼ��������BaCl2��Һ��Ȼ����ˡ�ϴ�ӡ�������أ��ù�������1.165g��
b.��һ������250mL��ƿ�У��������KI����ַ�Ӧ������0.5000 molL-1Na2S2O3��Һ�ζ����յ㣬���ı���Һ20.00mL��
��֪��I2+2S2O32�C=2I�C+S4O62�C����ɫ��
�ټ������ò�Ʒ��ѧʽ��n=_______��
����m=4��д�����ۺ������̵Ļ�ѧ����ʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�ڱ�״���£���CO��CO2��ɵĻ������8.96L��������16g���˻������CO��CO2�����ʵ���֮����_____________��CO�����������_____________���û�������������������ܶ�Ϊ________ ��
(2) 1.12g��������ijϡ����ǡ����ȫ��Ӧ���õ�100mL��Һ���Լ��㣺
�����ɵ������ڱ�״���µ������_________________
����Ӧ��������Һ�����ʵ����ʵ���Ũ����______________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��Ӹ���NaBr�Ĺ�ҵ��ˮ����ȡ Br2�Ĺ�����Ҫ��������������ȡ����Һ������Ȳ��衣��֪�������õ���������Ϣ��װ�����£�
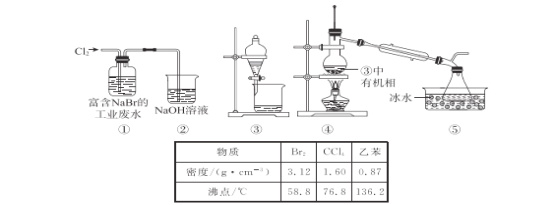
����˵���������
A.ʵ��ʱ�����ķ�Ӧ�����ӷ���ʽ��Cl2+2Br-=2Cl-+Br2
B.���еIJ���ֱ����û���һ�����۵�©������NaOH��ҺҺ������
C.����������ȡʱ��ѡ��CCl4���ұ�������
D.�����¶ȼ�ˮ�������֧�ܹ��࣬����Br2�IJ��ʵ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com