
【题目】(1)在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g。此混合物中CO和CO2的物质的量之比是_____________,CO的体积分数是_____________,该混合气体对于氢气的相对密度为________ 。
(2) 1.12g金属铁跟某稀盐酸恰好完全反应,得到100mL溶液,试计算:
①生成的气体在标准状况下的体积是_________________
②反应后所得溶液中溶质的物质的量浓度是______________________
【答案】1:3 25% 20 0.448L或448ml 0.2mol/L
【解析】
(1)设CO和CO2的物质的量分别为x、y,则
x+y=![]()
28x+44y=16;
(2)根据方程式计算。
(1)设CO和CO2的物质的量分别为x、y,则
x+y=![]()
28x+44y=16;
解得x=0.1mol,y=0.3mol,
则CO和CO2的物质的量之比是0.1mol:0.3mol=1:3,
CO的体积分数是![]() ×100%=25%,
×100%=25%,
混合气体的平均摩尔质量是![]() =40g·mol-1,该混合气体对于氢气的相对密度为40÷2=20;
=40g·mol-1,该混合气体对于氢气的相对密度为40÷2=20;
(2)Fe+2HCl=FeCl2+H2↑
56g 1mol 22.4L
1.12g n(FeCl2) V(H2)
![]() =
=![]() =
=![]()
解得n(FeCl2)=0.02mol V(H2)=0.448L
①生成的气体在标准状况下的体积是V(H2)=0.448L;
②n(FeCl2)=0.02mol,反应后所得溶液中溶质的物质的量浓度是0.02mol÷0.1L=0.2mol·L-1。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe2+基态核外电子排布式为______。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为_______。
(3)与CN-互为等电子体的一种分子为______(填化学式);1mol Fe(CN)63-中含有σ键的数目为______。
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于_______(填晶体类型)。
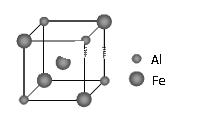
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。该合金的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 取一定量固体溶解,向溶液中通入足量的CO,观察到有晶体析出 | 原固体中一定含Na2CO3 |
B | 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成 | 原固体中一定含有Na2CO3 |
C | 取一定量固体,溶解,向溶液中滴加适量AgNO3 溶液,观察有白色沉淀生成 | 原固体中一定含有NaCl |
D | 称取3.80g固体,加热至恒重,质量减少了0.620g。用足量稀盐酸溶解残留固体,充分反应后,收集到有0.88g气体 | 原固体中三种物质都有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
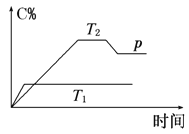
(1)温度T1________T2(填“大于”“等于”或“小于”)。
(2)正反应是________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m________2(填“大于”“等于”或“小于”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡___ _____移动(填“向正反应方向”“向逆反应方向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的![]() 元素的基态原子核外电子排布式:____________________。
元素的基态原子核外电子排布式:____________________。
(2)立方氮化硼(BN)可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼比晶体硅具有更高的硬度和耐热性的原因是______________________。
(3)![]() 分子中中心原子的杂化轨道类型是_________________,
分子中中心原子的杂化轨道类型是_________________,![]() 微粒的空间构型是_____________。
微粒的空间构型是_____________。
(4)![]() 被认为是有机化学中的“万能还原剂”,
被认为是有机化学中的“万能还原剂”,![]() 的电子式为_____________,其中三种元素的电负性由大到小的顺序是_____________________。
的电子式为_____________,其中三种元素的电负性由大到小的顺序是_____________________。
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作![]() ,实际上它的结构单元是由两个
,实际上它的结构单元是由两个![]() 和两个
和两个![]() 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成![]() ,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是_______________(填字母)。
,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是_______________(填字母)。
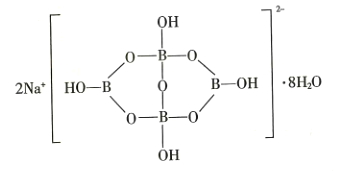
A.离子键 B.共价键 C.氢键 D.金属键 E.范德华力

(6)磷化硼的晶胞如图所示,其化学式为____________,若晶胞中硼原子与磷原子之间的最近核间距为apm,则晶胞边长为____________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】塑料、橡胶等材料的交联剂E的合成路线如图所示:
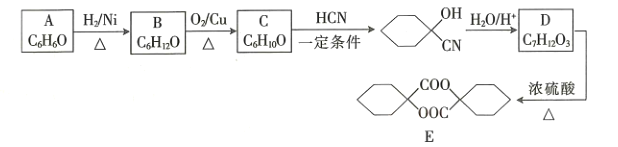
回答下列问题:
(1)B的名称为____________________。
(2)C生成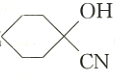 的反应类型是_________________,D中官能团的名称是________________。
的反应类型是_________________,D中官能团的名称是________________。
(3)D生成E的化学方程式为_____________________。
(4)E的同分异构体中符合下列条件的有______________种。(不考虑立体异构)
a.属于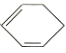 的二取代物
的二取代物
b.取代基处于对位且完全相同
c.能够与![]() 溶液反应产生
溶液反应产生![]()
其中核磁共振氢谱有4组峰,峰面积之比为6:2:1:1的结构简式为_______________。
(5)参照题干中合成路线,设计以丙酮为主要原料制备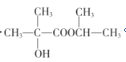 的合成路线______________(无机试剂任选)。
的合成路线______________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学设计实验实现几种价态硫元素的转化。
任务I:从以下试剂中选择合适的试剂实现S (+6)→S(+4)的转化。
试剂清单:①浓H2SO4 ②稀H2SO4 ③酸性KMnO4溶液 ④Na2SO3溶液 ⑤Cu ⑥品红
(1)写出实现转化的化学方程式_______________
(2)设计实验,证明实现了该转化(写出操作和现象)_______________。
II:实现硫元素在0、+2、+4价之间的转化。
查阅资料:+2价硫在酸性条件下不稳定,易发生自身氧化还原反应。
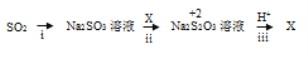
(3)i中加入的物质是__________ ,该转化利用的是SO2的_______性质。
(4)写出iii的离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ/mol。
2SO3(g) ΔH=-196.6 kJ/mol。
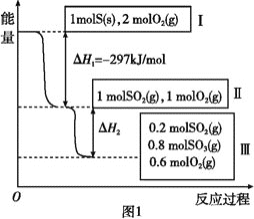
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:________________。
(2)状态Ⅱ到状态Ⅲ放出的热量为__________。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣_____(填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为______,若溶液中发生了氧化还原反应,则该过程的离子方程式为:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“连翘酯苷A”是“连花清瘟胶囊”的有效成分。如图有机物是“连翘酯苷A”的水解产物,其结构简式如图所示。下列有关该有机物的说法错误的是( )
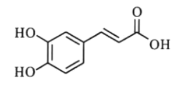
A.分子式为C9H8O4
B.分子中所有原子可能处于同一平面
C.1mol该分子最多可与5molH2发生加成反应
D.能与NaHCO3溶液反应放出CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com