
【题目】硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的![]() 元素的基态原子核外电子排布式:____________________。
元素的基态原子核外电子排布式:____________________。
(2)立方氮化硼(BN)可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼比晶体硅具有更高的硬度和耐热性的原因是______________________。
(3)![]() 分子中中心原子的杂化轨道类型是_________________,
分子中中心原子的杂化轨道类型是_________________,![]() 微粒的空间构型是_____________。
微粒的空间构型是_____________。
(4)![]() 被认为是有机化学中的“万能还原剂”,
被认为是有机化学中的“万能还原剂”,![]() 的电子式为_____________,其中三种元素的电负性由大到小的顺序是_____________________。
的电子式为_____________,其中三种元素的电负性由大到小的顺序是_____________________。
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作![]() ,实际上它的结构单元是由两个
,实际上它的结构单元是由两个![]() 和两个
和两个![]() 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成![]() ,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是_______________(填字母)。
,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是_______________(填字母)。
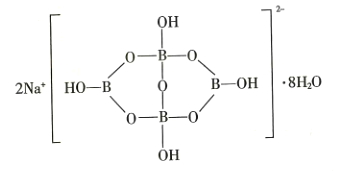
A.离子键 B.共价键 C.氢键 D.金属键 E.范德华力

(6)磷化硼的晶胞如图所示,其化学式为____________,若晶胞中硼原子与磷原子之间的最近核间距为apm,则晶胞边长为____________cm。
【答案】![]()
![]() 的键长比
的键长比![]() 的键长短(或
的键长短(或![]() 的键能较大)
的键能较大) ![]() 杂化 正四面体
杂化 正四面体 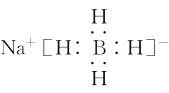
![]() D BP
D BP ![]()
【解析】
(1)Ga元素与B元素同主族,则其价电子排布为4s24p1,内层排满,所以电子排布为[Ar]3d104s24p1;
(2)原子晶体的硬度和耐热性与共价键强弱有关,B、N原子半径比Si原子半径小,B-N键比Si-Si键键长短,键能更大;
(3)BF3中心原子的价层电子对数为![]() =3,所以为sp2杂化;SiF4的中心原子的价层电子对数为
=3,所以为sp2杂化;SiF4的中心原子的价层电子对数为![]() =4,不含孤电子对,所以空间构型为正四面体;
=4,不含孤电子对,所以空间构型为正四面体;
(4)NaBH4是离子化合物,钠离子为阳离子,故NaBH4的电子式为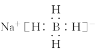 ;NaBH4中化合价Na为金属;故Na的电负性最小,后两种为非金属,B和H形成共价键;氢元素显负价,吸引电子能力更强;故元素的电负性大小顺序为:H>B>Na;
;NaBH4中化合价Na为金属;故Na的电负性最小,后两种为非金属,B和H形成共价键;氢元素显负价,吸引电子能力更强;故元素的电负性大小顺序为:H>B>Na;
(5)Na2B4O710H2O该盐中存在阴阳离子间的离子键、B和O原子之间存在共价键和配位键,水分子间存在氢键和范德华力,该物质中不含金属键,应选D项;
(6)根据均摊法,晶胞中B原子的个数为![]() =4;P原子的个数为4,所以化学式为BP;根据晶胞结构可知P原子和周围的4个B原子形成正四面体结构,根据几何知识可知B原子和P原子之间的最近距离为体对角线的
=4;P原子的个数为4,所以化学式为BP;根据晶胞结构可知P原子和周围的4个B原子形成正四面体结构,根据几何知识可知B原子和P原子之间的最近距离为体对角线的![]() ,设晶胞的边长为x,则有
,设晶胞的边长为x,则有![]() pm,所以x=
pm,所以x=![]() cm。
cm。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合溶液中加入足量的铜粉,从离子反应的角度分析,则最多能溶解铜粉的质量为( )
A. 9.6gB. 6.4 gC. 3.2 gD. 2.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向某密闭容器中加入0.2 mol CO和0.2 mol H2O,发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g),4 min时反应达到平衡状态,测得n(CO)∶n(CO2)=3∶2,下列说法正确的是
CO2(g)+H2(g),4 min时反应达到平衡状态,测得n(CO)∶n(CO2)=3∶2,下列说法正确的是
A.缩小容器的体积,混合气体的密度不变
B.v(CO)=v(CO2)时,表明反应达到平衡状态
C.平衡时CO和H2O的转化率相等
D.无法计算该条件下反应的化学平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁简称聚铁[Fe2(OH)6-2n(SO4)n]m广泛用于饮用水等的净化。某化工厂利用硫酸铜废液制备聚铁,其流程如下:

回答下列问题:
(1)试剂A为__________。
(2)本实验中两次加入硫酸,其中“加热浓缩“时加入稀硫酸,除了抑制离子水解,还为了_______,“聚合”时加硫酸是为了控制溶液的pH在一定范围内,若pH偏大,则_________。
(3)“控温氧化”时选用绿色氧化剂双氧水,该过程需要控温的原因是________。
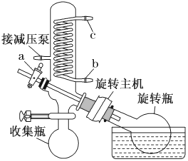
(4)减压蒸发装置如图所示。实验开始时,应先打开减压泵,从_____(填字母)口通入冷水,再打开旋转主机;实验结束时应先关闭旋转主机,再_______,打开阀门a通大气后,最后取下______(填仪器名称),从中获得聚铁。本实验采取减压蒸发的理由是___________。
(5)测定聚合硫酸铁样品主要成分的化学式。准确称取所得聚铁样品5.520g,溶于适量稀盐酸中,然后分成两等份:
a.一份加入过量的BaCl2溶液,然后过滤、洗涤、干燥,称重,得固体质量1.165g;
b.另一份置于250mL锥形瓶中,加入过量KI,充分反应后再用0.5000 molL-1Na2S2O3溶液滴定至终点,消耗标准溶液20.00mL。
已知:I2+2S2O32–=2I–+S4O62–(无色)
①计算所得产品化学式中n=_______。
②若m=4,写出“聚合”过程的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏伽德罗常数的值,下列说法不正确的是
为阿伏伽德罗常数的值,下列说法不正确的是
A.常温下,1LpH=10的![]() 溶液中所含
溶液中所含![]() 的数目为
的数目为![]() NA
NA
B.氯碱工业中转移2mol电子时,通过阳离子交换膜的![]() 的数目为2NA
的数目为2NA
C.过量的铜与含0.2mol![]() 的浓硝酸反应,转移电子的数目大于0.1NA
的浓硝酸反应,转移电子的数目大于0.1NA
D.室温下向1LpH=1的醋酸溶液中加水稀释,所得溶液中![]() 的数目大于0.1NA
的数目大于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g。此混合物中CO和CO2的物质的量之比是_____________,CO的体积分数是_____________,该混合气体对于氢气的相对密度为________ 。
(2) 1.12g金属铁跟某稀盐酸恰好完全反应,得到100mL溶液,试计算:
①生成的气体在标准状况下的体积是_________________
②反应后所得溶液中溶质的物质的量浓度是______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应:H2S(g)+ ![]() O2(g)=SO2(g)+H2O(g) △H1 ;2H2S(g)+SO2(g)=
O2(g)=SO2(g)+H2O(g) △H1 ;2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) △H2 ;H2S(g)+
S2(g)+2H2O(g) △H2 ;H2S(g)+ ![]() O2=S(g)+H2O △H3 ; 2S(g)=S2(g) △H4
O2=S(g)+H2O △H3 ; 2S(g)=S2(g) △H4
A. △H4=![]() (△H1+ △H2-3△H3)B. △H4=
(△H1+ △H2-3△H3)B. △H4=![]() (3△H3- △H1-△H2)
(3△H3- △H1-△H2)
C. △H4=![]() (△H1+△H2+3△H3)D. △H4=
(△H1+△H2+3△H3)D. △H4=![]() (△H1-△H2-3△H3)
(△H1-△H2-3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1
2H2O2(l)===2H2O(l)+O2(g) ΔH2
2H2(g)+O2(g)===2H2O(l) ΔH3
则反应Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)的ΔH是
A. ΔH=ΔH1+1/2ΔH2+1/2ΔH3 B. ΔH=ΔH1+1/2ΔH2-1/2ΔH3
C. ΔH=ΔH1+2ΔH2+2ΔH3 D. ΔH=2ΔH1+ΔH2+ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]比FeSO4稳定,不易被氧气氧化,常用于代替FeSO4作分析试剂。某小组尝试制备少量(NH4)2Fe(SO4)2·6H2O并探究其分解产物。

I.制备硫酸亚铁铵晶体的流程如下:
(1)铁屑溶于稀硫酸的过程中,适当加热的目的是_________。
(2)将滤液转移到_________中,迅速加入饱和硫酸铵溶液,直接加热蒸发混合溶液,观察到_________停止加热。蒸发过程保持溶液呈较强酸性的原因是_________。
Ⅱ.查阅资料可知,硫酸亚铁铵晶体受热主要发生反应:
____(NH4)2Fe(SO4)2·6H2O=____Fe2O3+____SO2↑+____NH3↑+____N2↑+____H2O
但伴有副反应发生,生成少量SO3和O2。设计以下实验探究部分分解产物:
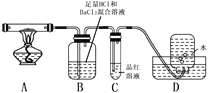
(3)配平上述分解反应的方程式。
(4)加热过程,A中固体逐渐变为_______色。
(5)B中迅速产生少量白色沉淀,反应的离子方程式为______。
(6)C的作用是_________。
(7)D中集气瓶能收集到O2,____ (填“能”或“不能”)用带火星木条检验。
(8)上述反应结来后,继续证明分解产物中含有NH3的方法是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com