
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应:H2S(g)+ ![]() O2(g)=SO2(g)+H2O(g) △H1 ;2H2S(g)+SO2(g)=
O2(g)=SO2(g)+H2O(g) △H1 ;2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) △H2 ;H2S(g)+
S2(g)+2H2O(g) △H2 ;H2S(g)+ ![]() O2=S(g)+H2O △H3 ; 2S(g)=S2(g) △H4
O2=S(g)+H2O △H3 ; 2S(g)=S2(g) △H4
A. △H4=![]() (△H1+ △H2-3△H3)B. △H4=
(△H1+ △H2-3△H3)B. △H4=![]() (3△H3- △H1-△H2)
(3△H3- △H1-△H2)
C. △H4=![]() (△H1+△H2+3△H3)D. △H4=
(△H1+△H2+3△H3)D. △H4=![]() (△H1-△H2-3△H3)
(△H1-△H2-3△H3)
科目:高中化学 来源: 题型:
【题目】结合氯气的相关知识解决下列问题。
(1)在实验室中制取Cl2,下列收集Cl2的装置中正确的是_______(填字母)。


漂白粉能与盐酸发生反应,但盐酸浓度不同时,漂白粉与盐酸混合发生反应的类型不同。
漂白粉与稀盐酸发生复分解反应,化学方程式为_________________________。漂白粉与浓盐酸发生氧化还原反应,化学方程式为____________________________________。
(2)氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。

①能证明氯水具有漂白性的是______(填“a”“b”“c”或“d”)。
②c过程中的现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~L分别表示中学化学中常见的一种物质,其中A、G为常见的金属单质,K、L为气体,K能使湿润的红色石蕊试纸变蓝,M由两种元素组成,其质量比8:1。
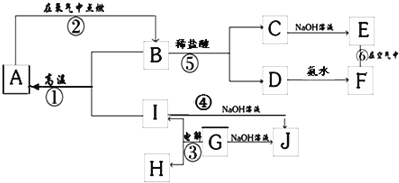
(1)K的电子式为_____
(2)反应②的离子方程式:_____,反应③的离子方程式:_____
(3)反应④的化学方程式:_____,反应⑥的化学方程式_____
(4)已知A和K反应为置换反应,则M的化学式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的![]() 元素的基态原子核外电子排布式:____________________。
元素的基态原子核外电子排布式:____________________。
(2)立方氮化硼(BN)可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼比晶体硅具有更高的硬度和耐热性的原因是______________________。
(3)![]() 分子中中心原子的杂化轨道类型是_________________,
分子中中心原子的杂化轨道类型是_________________,![]() 微粒的空间构型是_____________。
微粒的空间构型是_____________。
(4)![]() 被认为是有机化学中的“万能还原剂”,
被认为是有机化学中的“万能还原剂”,![]() 的电子式为_____________,其中三种元素的电负性由大到小的顺序是_____________________。
的电子式为_____________,其中三种元素的电负性由大到小的顺序是_____________________。
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作![]() ,实际上它的结构单元是由两个
,实际上它的结构单元是由两个![]() 和两个
和两个![]() 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成![]() ,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是_______________(填字母)。
,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是_______________(填字母)。
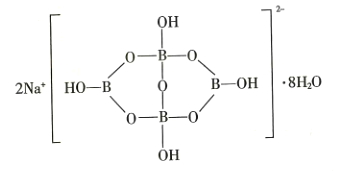
A.离子键 B.共价键 C.氢键 D.金属键 E.范德华力

(6)磷化硼的晶胞如图所示,其化学式为____________,若晶胞中硼原子与磷原子之间的最近核间距为apm,则晶胞边长为____________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为从粗食盐水中除去Ca2+、Mg2+、SO42-等离子,以制得精盐水。某同学设计如下方案:
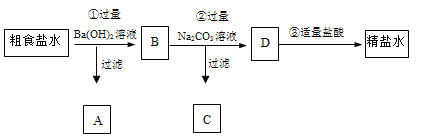
以下说法正确的是( )
A.A中主要有Mg(OH)2和BaSO4,也可能有一些Ca(OH)2
B.②中加入过量Na2CO3溶液的主要目的是为了除去Mg2+、Ca2+
C.D中有CO32-、Cl- 、Na+ 这3种离子
D.③中发生的反应只有2H++CO32-= H2O +CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学设计实验实现几种价态硫元素的转化。
任务I:从以下试剂中选择合适的试剂实现S (+6)→S(+4)的转化。
试剂清单:①浓H2SO4 ②稀H2SO4 ③酸性KMnO4溶液 ④Na2SO3溶液 ⑤Cu ⑥品红
(1)写出实现转化的化学方程式_______________
(2)设计实验,证明实现了该转化(写出操作和现象)_______________。
II:实现硫元素在0、+2、+4价之间的转化。
查阅资料:+2价硫在酸性条件下不稳定,易发生自身氧化还原反应。
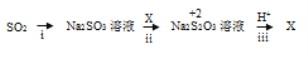
(3)i中加入的物质是__________ ,该转化利用的是SO2的_______性质。
(4)写出iii的离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生可逆反应的能量变化及反应历程如图所示。下列说法不正确的是

A.反应中Fe+是催化剂,FeO+是中间产物
B.当有14g N2生成时,转移1mol e
C.升高温度,总反应的平衡常数K减小
D.总反应速率由反应②的速率决定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B. 已知热化学方程式:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.2kJ·mol-1,则往密闭容器投入1mol的氮气和3mol氢气,反应后放热92.2千焦
2NH3(g) △H=-92.2kJ·mol-1,则往密闭容器投入1mol的氮气和3mol氢气,反应后放热92.2千焦
C. 常温下,吸热反应C(s)+CO2(g)=2CO(g)的△H>0
D. 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A. 反应物的总能量低于生成物的总能量时,该反应必须加热才能发生
B. 2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-akJ·mol-1,则中和热为a/2kJ·mol-1
C. 2H2(g)+O2(g)=2H2O(l);△H1=-akJ·mol-1,则氢气燃烧热为akJ·mol-1
D. N2(g)+3H2(g)=2NH3(g);△H=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com