
【题目】研究表明N2O与CO在Fe+作用下发生可逆反应的能量变化及反应历程如图所示。下列说法不正确的是

A.反应中Fe+是催化剂,FeO+是中间产物
B.当有14g N2生成时,转移1mol e
C.升高温度,总反应的平衡常数K减小
D.总反应速率由反应②的速率决定
【答案】D
【解析】
A.反应①中Fe+参加了反应:Fe++N2O→FeO++N2,生成了FeO+;反应②中FeO+被消耗,又生成了Fe+:FeO++CO→Fe++CO2,所以反应中Fe+是催化剂,FeO+是中间产物,故A正确;
B.总反应为CO +N2O=CO2+N2,生成1mol N2,转移2mol e,所以生成14g N2(即0.5molN2)转移1mol e,故B正确;
C.该反应的反应物的总能量高于生成物的总能量,所以反应为放热反应,升高温度,平衡逆向移动,平衡常数K减小,故C正确;
D.从图中可以看出,反应①的活化能高于反应②的活化能,所以反应①的速率慢,总反应速率由反应①决定,故D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源。当电池工作时,下列说法错误的是( )
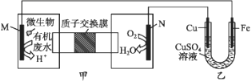
A. 甲中H+透过质子交换膜由左向右移动
B. M极电极反应式:H2N(CH2)2NH2+4H2O-16e-![]() 2CO2↑+N2↑+16H+
2CO2↑+N2↑+16H+
C. 一段时间后,乙中CuSO4溶液浓度基本保持不变
D. 当N极消耗0.25 mol O2时,则铁极增重16 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏伽德罗常数的值,下列说法不正确的是
为阿伏伽德罗常数的值,下列说法不正确的是
A.常温下,1LpH=10的![]() 溶液中所含
溶液中所含![]() 的数目为
的数目为![]() NA
NA
B.氯碱工业中转移2mol电子时,通过阳离子交换膜的![]() 的数目为2NA
的数目为2NA
C.过量的铜与含0.2mol![]() 的浓硝酸反应,转移电子的数目大于0.1NA
的浓硝酸反应,转移电子的数目大于0.1NA
D.室温下向1LpH=1的醋酸溶液中加水稀释,所得溶液中![]() 的数目大于0.1NA
的数目大于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应:H2S(g)+ ![]() O2(g)=SO2(g)+H2O(g) △H1 ;2H2S(g)+SO2(g)=
O2(g)=SO2(g)+H2O(g) △H1 ;2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) △H2 ;H2S(g)+
S2(g)+2H2O(g) △H2 ;H2S(g)+ ![]() O2=S(g)+H2O △H3 ; 2S(g)=S2(g) △H4
O2=S(g)+H2O △H3 ; 2S(g)=S2(g) △H4
A. △H4=![]() (△H1+ △H2-3△H3)B. △H4=
(△H1+ △H2-3△H3)B. △H4=![]() (3△H3- △H1-△H2)
(3△H3- △H1-△H2)
C. △H4=![]() (△H1+△H2+3△H3)D. △H4=
(△H1+△H2+3△H3)D. △H4=![]() (△H1-△H2-3△H3)
(△H1-△H2-3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学探究Ba(OH)2和H2SO4反应的实质,利用下图装置进行实验。向20 ml 0.01 mol/L Ba(OH)2 溶液中滴入几滴酚酞溶液,然后向其中匀速逐滴加入2 ml 0.2 mol/L H2SO4溶液。

(1)实验过程中溶液中的现象为________、 ________。
(2)该反应的离子方程式是__________________。
(3)画出反应过程中溶液电导率变化示意图__________________。
(4)解释反应过程中溶液电导率出现上述变化的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1
2H2O2(l)===2H2O(l)+O2(g) ΔH2
2H2(g)+O2(g)===2H2O(l) ΔH3
则反应Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)的ΔH是
A. ΔH=ΔH1+1/2ΔH2+1/2ΔH3 B. ΔH=ΔH1+1/2ΔH2-1/2ΔH3
C. ΔH=ΔH1+2ΔH2+2ΔH3 D. ΔH=2ΔH1+ΔH2+ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开1mol氢气中的化学键需要消耗436kJ能量,拆开1mol氧气中的化学键需要消耗498kJ能量,2mol氢气完全燃烧生成气态水放出482kJ热量,根据下面的能量图,回答下列问题:
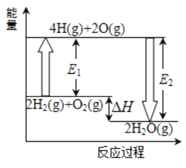
(1)分别写出E1 、E2的数值:E1=_______________;E2=_______________。
(2)生成H2O(g)中的1molH-O键放出_______kJ的能量。
(3)已知:H2O(l)=H2O(g) △H=+44kJmol-1,试写出2mol氢气在足量氧气中完全燃烧生成液态水的热化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe与水蒸气反应的实验"。

请回答该实验中的问题。
(1)实验前必须对整套装置进行气密性的检查,操作方法是_____________。
(2)圆底烧瓶中盛装的是水,该装置受热后的主要作用是_______________;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是_______________。
(3)酒精灯和酒精喷灯点燃的顺序是__________。
(4)干燥管中盛装的物质可以是_____________,作用是__________。
(5)如果要在A处玻璃管口处点燃该气体,则必须对该气体进行_________,这一操作的目的_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A. WZ的水溶液呈碱性
B. 元素非金属性的顺序为X>Y>Z
C. Y的最高价氧化物的水化物是中强酸
D. 该新化合物中Y不满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com