
【题目】某小组同学设计实验实现几种价态硫元素的转化。
任务I:从以下试剂中选择合适的试剂实现S (+6)→S(+4)的转化。
试剂清单:①浓H2SO4 ②稀H2SO4 ③酸性KMnO4溶液 ④Na2SO3溶液 ⑤Cu ⑥品红
(1)写出实现转化的化学方程式_______________
(2)设计实验,证明实现了该转化(写出操作和现象)_______________。
II:实现硫元素在0、+2、+4价之间的转化。
查阅资料:+2价硫在酸性条件下不稳定,易发生自身氧化还原反应。
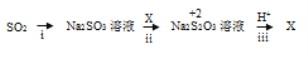
(3)i中加入的物质是__________ ,该转化利用的是SO2的_______性质。
(4)写出iii的离子方程式_____________。
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 将产生的气体通入品红溶液中,溶液褪色 NaOH溶液 酸性氧化物 2H++S2O32- = S↓+SO2↑+H2O
CuSO4+SO2↑+2H2O 将产生的气体通入品红溶液中,溶液褪色 NaOH溶液 酸性氧化物 2H++S2O32- = S↓+SO2↑+H2O
【解析】
I:(1)要实现S (+6)→S(+4)的转化,即反应过程中+6价的硫元素被还原为+4价的硫元素,也就是说含+6价的硫做氧化剂,+4价硫的物质做还原产物,需要加入还原剂完成上述转化过程;根据试剂清单,结合物质性质分析,能符合转化过程的为①浓H2SO4与⑤Cu反应生成硫酸铜、二氧化硫和水;
(2)要证明实现了该转化只需要证明产生二氧化硫,结合二氧化硫的性质证明即可;
II:(3)二氧化硫转变为亚硫酸钠过程中硫元素没有发生化合价变化,完成该转化过程,结合二氧化硫是酸性氧化物与碱反应的性质解答;
(4)根据题干信息,+2价硫在酸性条件下不稳定,易发生自身氧化还原反应,即发生歧化反应,+2价的硫化合价及升高又降低,结合步骤ii的反应亚硫酸钠和X反应生成硫代硫酸钠分析可得X中硫的化合价应低于+2价。
I:(1)要实现S (+6)→S(+4)的转化,即反应过程中+6价的硫元素被还原为+4价的硫元素,也就是说含+6价的硫做氧化剂,+4价硫的物质做还原产物,需要加入还原剂完成上述转化过程;根据试剂清单,结合物质性质分析,能符合转化过程的为①浓H2SO4与⑤Cu反应生成硫酸铜、二氧化硫和水,反应方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)要证明实现了该转化只需要证明产生二氧化硫,结合二氧化硫的漂白性,可将反应后产生的气体通入品红溶液中,若溶液褪色,即为实现上述转化,故答案为:将产生的气体通入品红溶液中,溶液褪色;
II:(3)二氧化硫转变为亚硫酸钠过程中硫元素没有发生化合价变化,完成该转化过程,结合二氧化硫是酸性氧化物与氢氧化钠溶液反应生成亚硫酸钠,故答案为:NaOH溶液;酸性氧化物;
(4)根据题干信息,+2价硫在酸性条件下不稳定,易发生自身氧化还原反应,即发生歧化反应,+2价的硫化合价及升高又降低,结合步骤ii的反应亚硫酸钠和X反应生成硫代硫酸钠分析可得X中硫的化合价应低于+2价,则X为硫单质,发生的反应为:2H++S2O32- = S↓+SO2↑+H2O,故答案为:2H++S2O32- = S↓+SO2↑+H2O。


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】对下列过程的化学用语表述正确的是
A. 用硫酸铜溶液除去乙炔中的硫化氢气体:H2S + Cu2+=== CuS↓ + 2H+
B. 向氯化铝溶液中滴入过量氨水:Al3+ + 4OH- === AlO2- + 2H2O
C. 用电子式表示Na和Cl形成NaCl的过程:![]()
D. 钢铁发生电化学腐蚀的正极反应:Fe-3e- === Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁简称聚铁[Fe2(OH)6-2n(SO4)n]m广泛用于饮用水等的净化。某化工厂利用硫酸铜废液制备聚铁,其流程如下:

回答下列问题:
(1)试剂A为__________。
(2)本实验中两次加入硫酸,其中“加热浓缩“时加入稀硫酸,除了抑制离子水解,还为了_______,“聚合”时加硫酸是为了控制溶液的pH在一定范围内,若pH偏大,则_________。
(3)“控温氧化”时选用绿色氧化剂双氧水,该过程需要控温的原因是________。
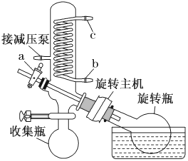
(4)减压蒸发装置如图所示。实验开始时,应先打开减压泵,从_____(填字母)口通入冷水,再打开旋转主机;实验结束时应先关闭旋转主机,再_______,打开阀门a通大气后,最后取下______(填仪器名称),从中获得聚铁。本实验采取减压蒸发的理由是___________。
(5)测定聚合硫酸铁样品主要成分的化学式。准确称取所得聚铁样品5.520g,溶于适量稀盐酸中,然后分成两等份:
a.一份加入过量的BaCl2溶液,然后过滤、洗涤、干燥,称重,得固体质量1.165g;
b.另一份置于250mL锥形瓶中,加入过量KI,充分反应后再用0.5000 molL-1Na2S2O3溶液滴定至终点,消耗标准溶液20.00mL。
已知:I2+2S2O32–=2I–+S4O62–(无色)
①计算所得产品化学式中n=_______。
②若m=4,写出“聚合”过程的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g。此混合物中CO和CO2的物质的量之比是_____________,CO的体积分数是_____________,该混合气体对于氢气的相对密度为________ 。
(2) 1.12g金属铁跟某稀盐酸恰好完全反应,得到100mL溶液,试计算:
①生成的气体在标准状况下的体积是_________________
②反应后所得溶液中溶质的物质的量浓度是______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应:H2S(g)+ ![]() O2(g)=SO2(g)+H2O(g) △H1 ;2H2S(g)+SO2(g)=
O2(g)=SO2(g)+H2O(g) △H1 ;2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) △H2 ;H2S(g)+
S2(g)+2H2O(g) △H2 ;H2S(g)+ ![]() O2=S(g)+H2O △H3 ; 2S(g)=S2(g) △H4
O2=S(g)+H2O △H3 ; 2S(g)=S2(g) △H4
A. △H4=![]() (△H1+ △H2-3△H3)B. △H4=
(△H1+ △H2-3△H3)B. △H4=![]() (3△H3- △H1-△H2)
(3△H3- △H1-△H2)
C. △H4=![]() (△H1+△H2+3△H3)D. △H4=
(△H1+△H2+3△H3)D. △H4=![]() (△H1-△H2-3△H3)
(△H1-△H2-3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1
2H2O2(l)===2H2O(l)+O2(g) ΔH2
2H2(g)+O2(g)===2H2O(l) ΔH3
则反应Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)的ΔH是
A. ΔH=ΔH1+1/2ΔH2+1/2ΔH3 B. ΔH=ΔH1+1/2ΔH2-1/2ΔH3
C. ΔH=ΔH1+2ΔH2+2ΔH3 D. ΔH=2ΔH1+ΔH2+ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组从富含NaBr的工业废水中提取 Br2的过程主要包括:氧化、萃取、分液、蒸馏等步骤。已知:可能用到的数据信息和装置如下:
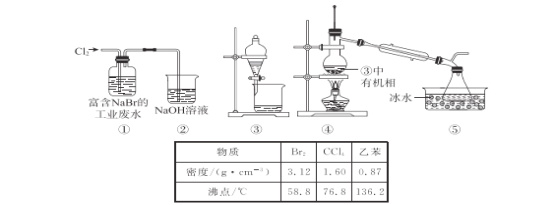
下列说法错误的是
A.实验时,①的反应的离子方程式:Cl2+2Br-=2Cl-+Br2
B.②中的玻璃直管最好换成一个倒扣的漏斗,与NaOH溶液液面相切
C.用③进行萃取时,选择CCl4比乙苯更合理
D.④中温度计水银球低于支管过多,导致Br2的产率低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是
A. ![]() B.
B. ![]() C. n=m+17Vc D.
C. n=m+17Vc D. ![]() m<p<
m<p<![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com