
【题目】下列有关金属的工业制法中正确的是( )
A.炼铝:用电解氯化铝溶液的方法获得单质铝
B.制钛:用金属钠置换熔融四氯化钛(TiCl4)中的钛
C.制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
D.炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中铁的氧化物
【答案】BD
【解析】
A、氯化铝是分子晶体,熔融的氯化铝中不含自由移动的离子;
B、Na是活泼金属,具有强还原性;
C、工业制钠是电解熔融NaCl来制取;
D、炼铁时的主要原理涉及CO与氧化铁的反应。
A、工业上常用惰性电极电解熔融的氧化铝来制取铝,化学方程式为2Al2O3![]() 4Al+3O2↑,故A错误;
4Al+3O2↑,故A错误;
B、Na是活泼金属,具有强还原性,利用钠的强还原性,可用金属钠置换熔融四氯化钛(TiCl4)中的钛,故B正确;
C、工业制钠是电解熔融NaCl:2NaCl![]() 2Na+Cl2↑,而电解纯净的NaCl溶液:2NaCl+2H2O
2Na+Cl2↑,而电解纯净的NaCl溶液:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,得不到钠,故C错误;
2NaOH+H2↑+Cl2↑,得不到钠,故C错误;
D、炼铁时的主要原理涉及CO与氧化铁的反应,CO在高温下还原铁矿石中铁的氧化物,可生成铁,故D正确;
答案选BD。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】二氧化硅是一种化工原料,可以制备一系列物质。下列说法正确的是( )
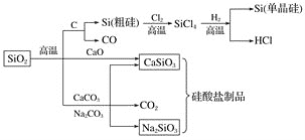
A.图中所有反应都不属于氧化还原反应
B.硅酸盐的化学性质稳定,常用于制造光导纤维
C.可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe2+基态核外电子排布式为______。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为_______。
(3)与CN-互为等电子体的一种分子为______(填化学式);1mol Fe(CN)63-中含有σ键的数目为______。
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于_______(填晶体类型)。
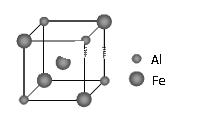
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。该合金的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A→C必须加热,否则会发生钝化现象。请回答下列问题:
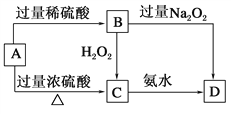
(1)A是________,你推断的理由是___________________。
(2)B在酸性条件下与H2O2反应的离子方程式:_____________________。
(3)A与过量浓H2SO4反应的化学方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单二苯乙炔类化合物是![]() 。以互为同系物的芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
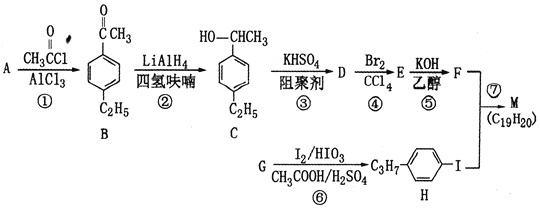
回答下列问题:
(1)G的结构简式为________________。
(2)C中含有的官能团名称是________________________。
(3)反应②的反应类型是________________,反应⑥的反应类型是________________。
(4)反应⑤的化学方程式为____________________。
(5)能同时满足下列条件的B的同分异构体有________种(不考虑立体异构)。
①苯环上有两个取代基 ②能发生银镜反应
写出其中核磁共振氢谱为5组峰,且峰面积之比为6:2:2:1:1的同分异构体的结构简式_______。
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线。_________________________
的合成路线。_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊烯是生产精细化工产品的重要中间体,其工业制备原理如图1。以Pd/Al2O3为催化剂,在相同反应时间内,测得不同温度下(其他条件相同)环戊二烯转化率与环戊烯产率的变化曲线如图2。下列说法正确的是()
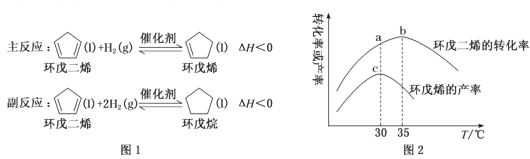
A.环戊二烯的转化率越大,越有利于环戊烯的生成
B.a点是主反应的平衡转化率,b点是副反应的平衡转化率
C.30℃~35℃之间环戊烯产率变化趋势与环戊二烯转化率不一致,原因是主反应被抑制,使环戊烯产率降低
D.30℃时催化剂的选择性最好,有利于提高生成环戊烯的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 取一定量固体溶解,向溶液中通入足量的CO,观察到有晶体析出 | 原固体中一定含Na2CO3 |
B | 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成 | 原固体中一定含有Na2CO3 |
C | 取一定量固体,溶解,向溶液中滴加适量AgNO3 溶液,观察有白色沉淀生成 | 原固体中一定含有NaCl |
D | 称取3.80g固体,加热至恒重,质量减少了0.620g。用足量稀盐酸溶解残留固体,充分反应后,收集到有0.88g气体 | 原固体中三种物质都有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
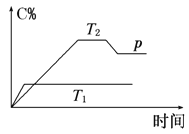
(1)温度T1________T2(填“大于”“等于”或“小于”)。
(2)正反应是________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m________2(填“大于”“等于”或“小于”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡___ _____移动(填“向正反应方向”“向逆反应方向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ/mol。
2SO3(g) ΔH=-196.6 kJ/mol。
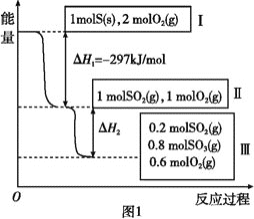
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:________________。
(2)状态Ⅱ到状态Ⅲ放出的热量为__________。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣_____(填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为______,若溶液中发生了氧化还原反应,则该过程的离子方程式为:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com