
【题目】密闭容器中充有10molCO与20molH2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。下列说法正确的是( )
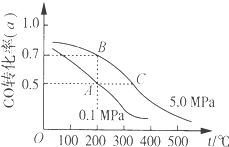
A.若A、B两点表示在某时刻达到的平衡状态,则A、B两点时容器内总气体的物质的量,n(A):n(B)=4:5
B.若A、C两点都表示已达到的平衡状态,则从反应开始至到达平衡状态所需的时间tA>tC
C.设B、C两点的平衡常数分别为KB、KC,则KB<KC
D.在不改变反应物用量的情况下,采取降温、减压或将甲醇从混合体系中分离出来均可提高CO的转化率
【答案】B
【解析】
A.A点CO的转化率为0.5,则参加反应的CO为10mol×0.5=5mol,则:
CO(g)+2H2(g)CH3OH(g)气体物质的量减少
1 2
5mol 10mol
故A点平衡时,混合气体总的物质的量=10mol+20mol-10mol=20mol;
B点CO的转化率为0.7,则参加反应的CO为10mol×0.7=7mol,则:
CO(g)+2H2(g)CH3OH(g)气体物质的量减少
1 2
7mol 14mol
故B点平衡时,混合气体总的物质的量=10mol+20mol-14mol=16mol;
故A、B两点时容器内总气体的物质的量之比n(A):n(B)=20mol:16mol=5:4,故A错误;
B.C点的温度、压强都高于A点,温度越高、压强越大,反应速率越快,最先到达平衡,故从反应开始至到达平衡状态所需的时间tA>tC,故B正确;
C.由图可知,一定压强下,温度越高,CO的转化率越低,说明升高温度平衡向逆反应方向移动,B的温度低于C点,故平衡常数KB>KC,故C错误;
D.正反应是气体体积减小的反应,减压平衡向逆反应方向移动,CO的转化率降低,故D错误;
答案为B。


科目:高中化学 来源: 题型:
【题目】如图所示,广口瓶中盛有气体X,胶头滴管中盛有液体Y,若挤压胶头滴管使液体滴入瓶中,振荡,一段时间后可见小球a膨胀鼓起。下表中的各组物质不出现上述现象的是( )

A. X为一氧化碳、Y为氢氧化钙溶液
B. X为二氧化碳、Y为氢氧化钠溶液
C. X为氯化氢、Y为氢氧化钡溶液
D. X为二氧化硫、Y为氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一体积恒定的密闭容器内发生反应A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再变化时,能够表明反应已达平衡的是( )
C(g)+D(g),当下列物理量不再变化时,能够表明反应已达平衡的是( )
A.气体的压强B.气体的总物质的量
C.气体的平均密度D.C和D的物质的量比是定值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:
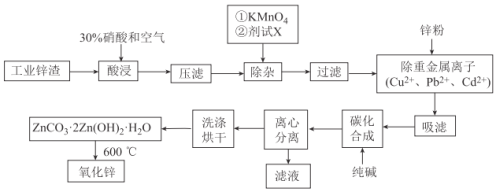
已知:相关金属离子c(Mn+)=0.1mol/L生成氢氧化物沉淀的pH如下表所示:
Fe3+ | Fe2+ | Al3+ | Mn2+ | Zn2+ | Cu2+ | Cd2+ | |
开始沉淀 | 1.5 | 6.3 | 3.4 | 8.1 | 6.2 | 6.0 | 7.4 |
沉淀完全 | 2.8 | 8.3 | 4.7 | 10.1 | 8.2 | 8.0 | 9.4 |
回答下列问题:
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5mol/L左右。写出一种加快锌渣浸出的方法:_______________
(2)为调节溶液的pH,则试剂X为__________________(填化学式),且调节溶液pH的范围是____________
(3)除杂时加入高锰酸钾的作用是_______________,发生反应的离子方程式为_____________
(4)“过滤”所得滤渣的主要成分是_____________________(填化学式)
(5)写出“碳化合成”的化学方程式:_____________________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:甲、乙、丙、丁为常见化合物,A、B为单质,相互转化关系如图。其中甲是天然气的主要成分。回答下列问题:
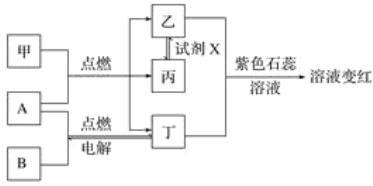
(1)丁物质的名称:______,丙物质的化学式:_________________________________________。
(2)检验化合物乙的化学方程式:___________________________________________________。
(3)试剂X可能的化学式:________、________(要求:所选物质类别不同)。
(4)通过分析表明:燃料充分燃烧的条件之一是______________________________。
(5)取变红溶液于试管中加热,观察到的现象有_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以![]() 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是
A.58.5 g氯化钠固体中含有![]() 个氯化钠分子
个氯化钠分子
B.1 mol Fe参与反应失去电子数目一定为2![]()
C.1 molNa被完全氧化生成Na202,失去2![]() 个电子
个电子
D.常温下,46 g N02和N204的混合物中含有的氮原子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着时代的发展,绿色环保理念越来越受到大家的认同,变废为宝是我们每一位公民应该养成的意识。某同学尝试用废旧的铝制易拉罐作为原材料、采用“氢氧化铝法”制取明矾晶体并进行一系列的性质探究。
制取明矾晶体主要涉及到以下四个步骤:
第一步:铝制品的溶解。取一定量铝制品,置于250mL锥形瓶中,加入一定浓度和体积的强碱溶液,水浴加热(约93℃),待反应完全后(不再有氢气生成),趁热减压抽滤,收集滤液于250mL烧杯中;
第二步:氢氧化铝沉淀的生成。将滤液重新置于水浴锅中,用3 mol/L H2SO4调节滤液pH至8~9,得到不溶性白色絮凝状Al(OH)3,减压抽滤得到沉淀;
第三步:硫酸铝溶液的生成。将沉淀转移至250mL烧杯中,边加热边滴入一定浓度和体积的H2SO4溶液;
第四步:硫酸铝钾溶液的形成。待沉淀全部溶解后加入一定量的固体K2SO4,将得到的饱和澄清溶液冷却降温直至晶体全部析出,减压抽滤、洗涤、抽干,获得产品明矾晶体[KAl(SO4)2·12H2O,M=474g/mol]。
回答下列问题:
(1)第一步铝的溶解过程中涉及到的主要反应的离子方程式为__________________________
(2)为了加快铝制品的溶解,应该对铝制品进行怎样的预处理:________________________
(3)第四步操作中,为了保证产品的纯度,同时又减少产品的损失,应选择下列溶液中的___(填选项字母)进行洗涤,实验效果最佳。
A.乙醇 B.饱和K2SO4溶液 C.蒸馏水 D.1:1乙醇水溶液
(4)为了测定所得明矾晶体的纯度,进行如下实验操作:准确称取明矾晶体试样4.0g于烧杯中,加入50mL 1mol/L盐酸进行溶解,将上述溶液转移至100mL容量瓶中,稀释至刻度线,摇匀;移取25.00 mL溶液干250 mL锥形瓶中,加入30 mL 0.10mol/L EDTA-2Na标准溶液,再滴加几滴2D二甲酚橙,此时溶液呈黄色;经过后续一系列操作,最终用0.20 mol/L锌标准溶液滴定至溶液由黄色变为紫红色,达到滴定终点时,共消耗5.00 mL锌标准溶液。滴定原理为H2Y2-+Al3+→AlY-+2H+,H2Y2-(过量)+Zn2+→ZnY2-+2H+(注:H2Y2-表示EDTA-2Na标准溶液离子)。则所得明矾晶体的纯度为_________%。
(5)明矾除了可以用作人们熟悉的净水剂之外,还常用作部分食品的膨松剂,例如油条(饼)的制作过程需要加入一定量的明矾,请简述明矾在面食制作过程作膨松剂的原理:_______
(6)为了探究明矾晶体的结晶水数目及分解产物,在N2气流中进行热分解实验,得到明矾晶体的热分解曲线如图所示(TG%代表的是分解后剩余固体质量占样品原始质量的百分率,失重百分率=![]() ×100%):
×100%):
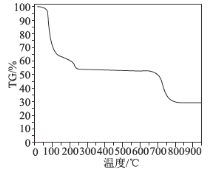
根据TG曲线出现的平台及失重百分率,30~270℃范围内,失重率约为45.57%,680~810℃范围内,失重百分率约为25.31%,总失重率约为70.88%,请分别写出所涉及到30~270℃、680~810℃温度范围内这两个阶段的热分解方程式:___________、_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结 论 |
A | 将 | 生成了 |
B | 向浓度均为 |
|
C | 淀粉 | 还原性: |
D | 用pH试纸测得: |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“稀土之父”徐光宪对稀土萃取分离做出了巨大贡献。稀土是隐形战机、超导、核工业等高精尖领域必备的原料。钪(Sc)是稀土金属之一,如图是制备Sc的工艺流程。

已知:xNH4ClyScF3zH2O是ScF3与氯化物形成的复盐沉淀,在强酸中部分溶解。“脱水除铵”是复盐沉淀的热分解过程。
据此回答:
(1)在空气中焙烧Sc2(C2O4)3只生成一种碳氧化物的化学方程式为 ________。
(2)图1是含Sc元素的离子与F-浓度和pH的关系。用氨调节溶液pH,调节3.5<pH<4.2原因是________。
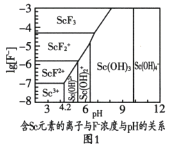
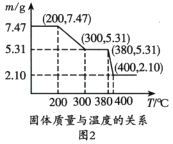
(3)图2是“脱水除铵”过程中固体质量与温度的关系,其中在380℃到400℃会有白烟冒出,保温至无烟气产生,即得到ScF3,由图像中数据计算复盐中x:z=________;工艺流程中可回收利用的物质是________。
(4)传统制备ScF3的方法是先得到ScF36H2O沉淀,再高温脱水得ScF3,但通常含有ScOF杂质,原因是________(用化学方程式表示)。流程中将复盐沉淀后“脱水除铵”制得纯度很高的SeF3,其原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com