
【题目】随着时代的发展,绿色环保理念越来越受到大家的认同,变废为宝是我们每一位公民应该养成的意识。某同学尝试用废旧的铝制易拉罐作为原材料、采用“氢氧化铝法”制取明矾晶体并进行一系列的性质探究。
制取明矾晶体主要涉及到以下四个步骤:
第一步:铝制品的溶解。取一定量铝制品,置于250mL锥形瓶中,加入一定浓度和体积的强碱溶液,水浴加热(约93℃),待反应完全后(不再有氢气生成),趁热减压抽滤,收集滤液于250mL烧杯中;
第二步:氢氧化铝沉淀的生成。将滤液重新置于水浴锅中,用3 mol/L H2SO4调节滤液pH至8~9,得到不溶性白色絮凝状Al(OH)3,减压抽滤得到沉淀;
第三步:硫酸铝溶液的生成。将沉淀转移至250mL烧杯中,边加热边滴入一定浓度和体积的H2SO4溶液;
第四步:硫酸铝钾溶液的形成。待沉淀全部溶解后加入一定量的固体K2SO4,将得到的饱和澄清溶液冷却降温直至晶体全部析出,减压抽滤、洗涤、抽干,获得产品明矾晶体[KAl(SO4)2·12H2O,M=474g/mol]。
回答下列问题:
(1)第一步铝的溶解过程中涉及到的主要反应的离子方程式为__________________________
(2)为了加快铝制品的溶解,应该对铝制品进行怎样的预处理:________________________
(3)第四步操作中,为了保证产品的纯度,同时又减少产品的损失,应选择下列溶液中的___(填选项字母)进行洗涤,实验效果最佳。
A.乙醇 B.饱和K2SO4溶液 C.蒸馏水 D.1:1乙醇水溶液
(4)为了测定所得明矾晶体的纯度,进行如下实验操作:准确称取明矾晶体试样4.0g于烧杯中,加入50mL 1mol/L盐酸进行溶解,将上述溶液转移至100mL容量瓶中,稀释至刻度线,摇匀;移取25.00 mL溶液干250 mL锥形瓶中,加入30 mL 0.10mol/L EDTA-2Na标准溶液,再滴加几滴2D二甲酚橙,此时溶液呈黄色;经过后续一系列操作,最终用0.20 mol/L锌标准溶液滴定至溶液由黄色变为紫红色,达到滴定终点时,共消耗5.00 mL锌标准溶液。滴定原理为H2Y2-+Al3+→AlY-+2H+,H2Y2-(过量)+Zn2+→ZnY2-+2H+(注:H2Y2-表示EDTA-2Na标准溶液离子)。则所得明矾晶体的纯度为_________%。
(5)明矾除了可以用作人们熟悉的净水剂之外,还常用作部分食品的膨松剂,例如油条(饼)的制作过程需要加入一定量的明矾,请简述明矾在面食制作过程作膨松剂的原理:_______
(6)为了探究明矾晶体的结晶水数目及分解产物,在N2气流中进行热分解实验,得到明矾晶体的热分解曲线如图所示(TG%代表的是分解后剩余固体质量占样品原始质量的百分率,失重百分率=![]() ×100%):
×100%):
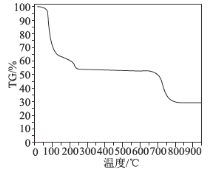
根据TG曲线出现的平台及失重百分率,30~270℃范围内,失重率约为45.57%,680~810℃范围内,失重百分率约为25.31%,总失重率约为70.88%,请分别写出所涉及到30~270℃、680~810℃温度范围内这两个阶段的热分解方程式:___________、_____________
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ 用砂纸将废旧铝制易拉罐内外表面打磨光滑,并剪成小片备用(其他合理答案也给分) D 94.8 明矾与小苏打(NaHCO3)发生反应(双水解):Al3++3HCO3-=Al(OH)3↓
+3CO2↑,产生大量CO2,使面食内部体积迅速膨胀,形成较大空隙。 KAl(SO4)212H2O![]() KAl(SO4)2+12H2O 2KAl(SO4)2
KAl(SO4)2+12H2O 2KAl(SO4)2![]() K2SO4+Al2O3+3SO3↑
K2SO4+Al2O3+3SO3↑
【解析】
(1)铝与强碱溶液的反应生成偏铝酸盐和氢气,写出离子方程式;
(2)预处理需要去掉铝表面的致密的氧化物保护膜;
(3)从减少产品损失考虑;
(4)根据题目信息及滴定原理可知,用EDTA-2Na的总量减去锌标准溶液对EDTA-2Na的消耗量,即可计算出样品溶液中Al3+的物质的量,间接算出明矾晶体的物质的量和质量,进而求出明矾晶体的纯度;
(5)从双水解角度考虑;
(6)根据题目所给数据,确定第一个阶段应是脱掉结晶水;第二阶段脱掉SO3;
(1)第一步铝的溶解过程中主要发生铝与强碱溶液的反应,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
答案:2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)铝制品表面有氧化膜及包装油漆喷绘等,打磨、剪成小片后可加快在强碱溶液中的溶解;
答案:用砂纸将废旧铝制易拉罐内外表面打磨光滑,并剪成小片备用(其他合理答案也给分)
(3)所得明矾晶体所含的杂质能溶于水,需用水洗涤,但为了减少产品的损失,应控制水的比例,因此用1:1乙醇水溶液洗涤效果最佳;
答案:D
(4)根据题目信息及滴定原理可知,用EDTA-2Na的总量减去锌标准溶液对EDTA-2Na的消耗量,即可计算出样品溶液中Al3+的物质的量,间接算出明矾晶体的物质的量和质量,进而求出明矾晶体的纯度;
答案:94.8
(5)面食发酵过程中需要用到小苏打(NaHCO3),NaHCO3与明矾发生双水解反应,产生CO2;
答案:明矾与小苏打(NaHCO3)发生反应(双水解):Al3++3HCO3-=Al(OH)3↓
+3CO2↑,产生大量CO2,使面食内部体积迅速膨胀,形成较大空隙。
(6)根据题目所给数据,结合KAl(SO4)212H2O的化学式,可验证出第一个阶段应是脱掉结晶水得到KAl(SO4)2;第二阶段脱掉SO3,发生的是非氧化还原反应,得到K2SO4和Al2O3;
答案:KAl(SO4)212H2O![]() KAl(SO4)2+12H2O 2KAl(SO4)2
KAl(SO4)2+12H2O 2KAl(SO4)2![]() K2SO4+Al2O3+3SO3↑
K2SO4+Al2O3+3SO3↑


科目:高中化学 来源: 题型:
【题目】以乙烯与甲苯为主要原料,按下列路线合成一种香料W:

(1)实验室制备乙烯的反应试剂与具体反应条件为____。
(2)上述①~④反应中,属于取代反应的是___。
(3)检验反应③是否发生的方法是____。
(4)写出两种满足下列条件的![]() 同分异构体的结构简式。____、____。
同分异构体的结构简式。____、____。
a.能发生银镜反应 b.苯环上的一溴代物有两种
(5)设计一条由乙烯制备A的合成路线。(无机试剂可以任选)____。
(合成路线常用的表示方式为: )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3 mol NH3分子中所含原子数与________个H2O分子中所含原子数相等。
(2)0.1 mol/L Al2(SO4)3溶液100mL与0.3mol/LK2SO4溶液200mL混合,则所得溶液中硫酸根离子的物质的量浓度为__________。(混合后,忽略体积变化)
(3)相同质量的SO2、SO3的氧原子的个数之比为____,体积比_______。
(4)液态化合物在一定量的氧气中恰好完全燃烧,反应方程式为:XY2(l)+3O2(g)=XO2(g)+2YO2(g)冷却后,在标准状况下测得生成物的体积是336mL,密度是2.56g/L.
①反应前O2的体积是_____mL(标准状况),化合物XY2的摩尔质量是_____.
②若XY2分子中X、Y两元素的质量比是3:16,则X、Y两元素分别为_____和_____(写元素符号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔在不同条件下可以转化成许多化合物,如图,下列叙述错误的是( )
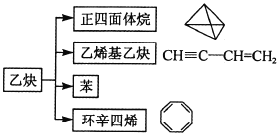
A. 正四面体烷的一氯代物及二氯代物均只有1种
B. 乙炔生成乙烯基乙炔是加成反应
C. ![]() 与环辛四烯(C8H8)互为同分异构体
与环辛四烯(C8H8)互为同分异构体
D. 等质量的苯与乙烯基乙炔完全燃烧时的耗氧量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中 A、B、C、D 分别是三种烃的分子结构,请回答下列问题:
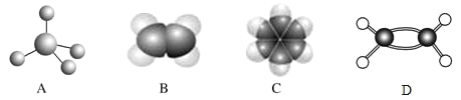
(1)上图中 D 是有机物分子的_____模型;
(2)烃 A 及其同系物的分子式符合通式_____(碳原子个数用 n 表示),当 n=6 时的同分异构体数目为_____(填数字)种;
(3)上述三种有机物烃中,所有原子均共平面的是_________(填有机物的名称);
(4)下列关于烃 C 的叙述正确的是_____(填序号)。
A.分子式为 C6H6,它不能使酸性 KMnO4 溶液褪色,属于饱和烃
B.从分子结构看,C 分子中含有碳碳双键,属于烯烃
C.烃 C 的同系物二甲苯(C8H10)有三种不同的结构,均属于芳香烃
D.烃 C 中加入溴水,充分振荡,静置,下层无色
(5)分别写出 B 使溴水褪色、C 的溴代反应的化学方程式____________、_____________,并指明反应类型:________________、______________
(6)C 的同系物甲苯与足量氢气加成后的产物(甲基环己烷)的一氯代物有_____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
化学键 | 键能kJ/mol |
H-H | 436 |
N-H | 391 |
N | 946 |
下列说法正确的是
A. 该反应为吸热反应B. 该反应中反应物的总能量高于生成物的总能量
C. 反应热ΔH=92 kJ·mol-1D. 生成1 mol NH3放出92 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铊(Tl)是某超导材料的组成元素之一,与铝同族,位于周期表第六周期。Tl3+与银在酸性溶液中发生反应:Tl3++2Ag![]() Tl++2Ag+,下列推断正确的是( )
Tl++2Ag+,下列推断正确的是( )
A.Tl+的最外层有1个电子B.Tl能形成+3价和+1价的化合物
C.Tl3+氧化性比铝离子弱D.Tl+的还原性比Ag强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成用四氯化碳制取碘水中的碘的相关实验内容(装置图见图 2)

图 2
(1)实验步骤:装液、振荡、静置和分层、_____。
(2)实验原理:利用碘在四氯化碳中的溶解度比在水中的溶解度_____;四氯化碳与水_____;
(3)实验现象:碘的四氯化碳溶液呈_____色;碘的四氯化碳溶液在_____层;
(4)注意事项:振荡时,须不断放气,以减小分液漏斗内压强。分液时,须将分液漏斗上的玻璃塞_____________,或使玻璃塞上的凹槽(或小孔)对准漏斗上的小孔;分液时,碘的四氯化碳溶液从分液漏斗_________口倒出,水从分液漏斗 _________口流出;漏斗颈的下端要紧贴烧杯的内壁。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(CN)2的氧化性比Br2弱而比I2强,NaCN的水溶液呈碱性,则下列有关变化一般不能发生的是
A. CH2=CH2+(CN)2→NC-CH2-CH2-CN
B. (CN)2+2Br-→2CN-+Br2
C. (CN)2+2OH-→CN-+CNO-+H2O
D. HCN![]() H++CN-
H++CN-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com