
【题目】在一定温度下的定容密闭容器中,下列情况表明反应A(s)+2B(g)![]() C(g)+D(g) 已达到反应限度的是
C(g)+D(g) 已达到反应限度的是
A. 混合气体的密度保持不变B. 有1mol C生成的同时有1mol D生成
C. 混合气体的总物质的量保持不变D. 有1 mol A生成的同时有1mol C消耗
科目:高中化学 来源: 题型:
【题目】已知某烷烃的相对分子质量为72。回答下列问题:
(1)写出该烷烃的分子式__。
(2)写出其同分异构体的结构简式__。
(3)若此烷烃的一氯代物分子中有三个—CH3,一个—CH2—,其结构简式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.00mL于锥形瓶中,加入10.00mLKI溶液(足量),滴入指示剂2~3滴。
②取一只碱式滴定管依次用自来水、蒸馏水洗净,然后注入0.010mol·L-1Na2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+Na2S4O6。
试回答下列问题:
(1)步骤①加入的指示剂是___。
(2)滴定时,眼睛应注视___,判断到达滴定终点的现象是__,若耗去Na2S2O3溶液20.00mL,则废水中Cl2的物质的量浓度为___。
(3)实验中,Cl2的所测浓度比实际浓度偏大,造成误差的原因是___。
(4)如图表示50.00mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25.00mL,滴定管中液面读数应为___mL,设此时液体体积读数为amL,滴定管中液体的体积V___(50-a)mL(填“<”、“=”或“>”)。
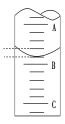
(5)滴定结束时俯视刻度线读取滴定终点时Na2S2O3溶液的体积,会导致测定结果__(填“偏大”、“偏小”或“不影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,对于某可逆反应中某一反应物从开始O点到达到平衡状态C点的过程的浓度变化情况。下列有关说法正确的是
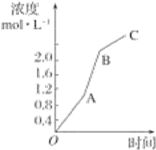
A.此可逆反应为A![]() B+C
B+C
B.反应过程中OA段的速率最快
C.反应过程中AB段的速率最快
D.反应过程中BC段的速率最快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池(PEMFC) 常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是
①正极反应为:O2+4H++4e- ═2H2O
②负极反应为:2H2-4e- ═4H+
③总的化学反应为:2H2+O2![]() 2H2O
2H2O
④H+通过电解质向正极移动
A.①②③④ B.②③④ C.①②④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 若在1L的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,该反应达到平衡状态
D. 若平衡浓度符合下列关系式:![]() ,则此时的温度为1000℃
,则此时的温度为1000℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:用Pt—Rh合金催化氧化NH3制NO,其反应的微观模型及含氮生成物产率随反应温度的变化曲线分别如所示:
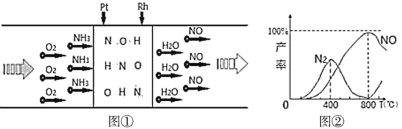
下列说法中,不正确的是( )
A.400℃时,生成的产物只有N2、NO
B.800℃时,反应的化学方程式是:4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C.Pt—Rh合金可有效提升NH3催化氧化反应的速率
D.800℃以上,发生了反应:2NO![]() O2(g)+N2(g) ΔH>0
O2(g)+N2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1 mol·L-1,加入等体积0.3 mol·L-1的BaCl2溶液恰好使![]() 完全沉淀,则混合溶液中Na+的浓度为________。
完全沉淀,则混合溶液中Na+的浓度为________。
(2)将0.1 mol·L-1的K2SO4溶液、0.2 mol·L-1的Al2(SO4)3溶液和纯水混合,要使混合液中K+、Al3+、![]() 的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
(3)在标准状况下,将一个充满HCl气体和氧气的集气瓶倒放于盛水的水槽中,水面上升至集气瓶容积的![]() ,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com