
【题目】据媒体报道,以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池(PEMFC) 常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是
①正极反应为:O2+4H++4e- ═2H2O
②负极反应为:2H2-4e- ═4H+
③总的化学反应为:2H2+O2![]() 2H2O
2H2O
④H+通过电解质向正极移动
A.①②③④ B.②③④ C.①②④ D.①②③
科目:高中化学 来源: 题型:
【题目】从有机反应![]() 制取副产品盐酸的设想己成为现实。请根据所给模拟装置图回答下列问题:
制取副产品盐酸的设想己成为现实。请根据所给模拟装置图回答下列问题:
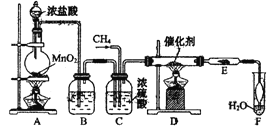
(1)写出实验室制Cl2的离子方程式________________________。
(2)装置B中盛放的溶液是____________;作用是___________________。
(3)装置C有三种功能:①_________;②__________;③观察气泡的产生情况,便于控制两种气体的配比。
(4)玻璃管E中放在石棉碎块上的碘化钾的作用是:_______________。导管末端“肚形”装置的作用是____________________________。
(5)从F中分离出盐酸的最佳方法是____________。该套实验装置还存在的缺陷是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO、CO2的应用具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ;
CH3OH(g)+H2O(g) ;
测得CH3OH的物质的量随时间的变化图:

①由图判断该反应ΔH 0,曲线I、II对应的平衡常数KI KII(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
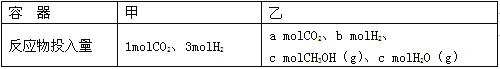
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有3个C-H形成
(3)将燃煤废气中的CO转化为二甲醚的反应原理为:
2CO(g) + 4H2(g)![]() CH3OCH3(g) + H2O(g)。二甲醚与空气可设计成燃料电池,若电解质为碱性。写出该燃料电池的负极反应式 。根据化学反应原理,分析增加压强对制备二甲醚反应的影响 。
CH3OCH3(g) + H2O(g)。二甲醚与空气可设计成燃料电池,若电解质为碱性。写出该燃料电池的负极反应式 。根据化学反应原理,分析增加压强对制备二甲醚反应的影响 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为短周期内除稀有气体外的元素,它们的原子序数依次增大。四种元素中只有C为金属元素;A和C的最外层电子数相等;B、D属于同主族;C、D两元素原子的质子数之和为A、B两元素原子的质子数之和的3倍。请回答下列问题:
(1)A的元素符号为______,B的原子结构示意图为______。
(2)写出C2B2与A2B反应的离子方程式____ _。
(3)A、B、C、D离子半径由大到小的顺序为 。(用离子符号表示)
(4)用化学方程式证明元素原子的得电子能力B强于D__ ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)有机化合物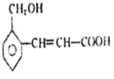 可能发生的化学反应有
可能发生的化学反应有
①加成 ②氧化 ③燃烧 ④加聚 ⑤取代
A.①②③ B.①②③④⑤ C.①②③④ D.①③④
(二)已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成食品包装材料。
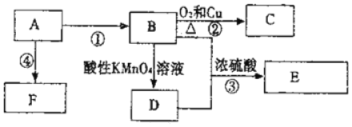
(1)A的结构简式为 。
(2)D分子中的官能团是 。
(3)写出下列反应的化学方程式。
② 。
④ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)基态硅原子的电子排布式:_______________。
(2)有一类组成最简单的有机硅化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似。硅烷中硅采取____杂化方式,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是_______________。
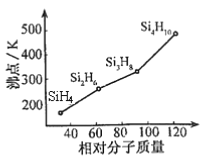
(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为_______。 (用元素符号表示)
(4)气态SeO3分子的立体构型为_________,与SeO3互为等电子体的一种离子为____________(填化学式)。
(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为_________;若该晶体的晶胞棱长为a pm,则该合金密度为______g/cm 3。(列出计算式,不要求计算结果,阿伏伽德罗常数的值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学课外兴趣小组学生在实验室里制取的乙烯中长混有少量的二氧化硫,老师启发他们并由他们自己设计了下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题
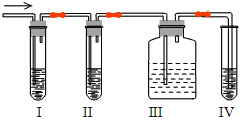
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是I ;Ⅱ ;Ⅲ ;Ⅳ 。依次填为( )
①品红溶液 ②NaOH溶液 ③浓硫酸 ④酸性KMnO4溶液
A.④②①③ B.①②①③ C.①②①④ D.④②①④
(2)能说明SO2气体存在的现象是____________。
(3)使用装置Ⅲ的目的是____________。
(4)确定含有乙烯的现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下面列出了几组物质,请将物质的合适组号填写在空格上。
同素异形体 , 同分异构体 。
①金刚石与“足球烯”( C60 ); ② D与T ; ③ 16O、17O和18O ;④ 氧气(O2)与臭氧(O3); ⑤ CH4和CH3CH2CH3 ; ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑦![]() 和
和![]() ; ⑧尿素[CO(NH2)2]和 氰酸铵(NH4CNO)
; ⑧尿素[CO(NH2)2]和 氰酸铵(NH4CNO)
(2)H2O2、KCl、Na2SO4、Na2O2、NH3、O2中只含离子键的是 ,既有极性键又有非极性键的是 。既含离子键又含非极性键的物质的电子式是 ,请用电子式表示只含极性键的物质的形成过程: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | ||||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
请按要求回答下列问题。
(1)元素⑧的名称是______,元素⑧在周期表中所处位置___________。元素④的氢化物沸点高于⑦的氢化物沸点,原因是_________________________________________。
(2)④⑥⑦的氢化物按稳定性由弱到强的顺序是________________________(写氢化物的化学式)。
(3)元素②④形成原子个数比为1:2的化合物的电子式是 。
(4)元素②形成的一类氢化物称为烷烃,通式是___________,其中 (填分子式)有两种同分异构体,结构简式分别是____________________________________。
(5)用电子式表示⑤与⑦形成化合物的过程_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com