
【题目】A、B、C、D为短周期内除稀有气体外的元素,它们的原子序数依次增大。四种元素中只有C为金属元素;A和C的最外层电子数相等;B、D属于同主族;C、D两元素原子的质子数之和为A、B两元素原子的质子数之和的3倍。请回答下列问题:
(1)A的元素符号为______,B的原子结构示意图为______。
(2)写出C2B2与A2B反应的离子方程式____ _。
(3)A、B、C、D离子半径由大到小的顺序为 。(用离子符号表示)
(4)用化学方程式证明元素原子的得电子能力B强于D__ ___。
【答案】(1)H;![]() ;
;
(2)2Na2O2+2H2O═4Na++4OH-+O2↑;
(3)S2->O2->Na+>H+;
(4)2H2S+O2═2H2O+S↓。
【解析】试题分析:A、B、C、D为短周期内除稀有气体外的元素,它们的原子序数依次增大,C为金属元素;A和C的最外层电子数相等,位于同主族,则C为Na,A为H;B、D属于同主族,设B的质子数为x,则D的质子数为x+8,C、D两元素原子的质子数之和为A、B两元素原子的质子数之和的3倍,所以11+x+8=(1+x)×3,解得x=8,即B为O,D为S。(1)A为H,B为O,其原子结构示意图为![]() ;(2)C2B2为Na2O2,钠离子与过氧根离子以离子键结合,O、O之间以共价键结合,与水反应的离子反应为2Na2O2+2H2O═ 4Na++ 4OH-+O2↑;;(3)离子核外电子层越多,离子半径越大,具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为S2->O2->Na+>H+;(4)利用元素单质的置换反应可说明得电子能力的强弱,如2H2S+O2═2H2O+S↓。
;(2)C2B2为Na2O2,钠离子与过氧根离子以离子键结合,O、O之间以共价键结合,与水反应的离子反应为2Na2O2+2H2O═ 4Na++ 4OH-+O2↑;;(3)离子核外电子层越多,离子半径越大,具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为S2->O2->Na+>H+;(4)利用元素单质的置换反应可说明得电子能力的强弱,如2H2S+O2═2H2O+S↓。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种物质:

(1)乙中含有的官能团的名称为________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
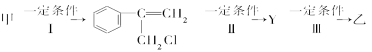
其中反应Ⅰ的反应类型是______________,反应Ⅱ的条件是__________________,反应Ⅲ的化学方程式为_________________(不需注明反应条件)。
(3)由甲出发合成丙的路线之一如下
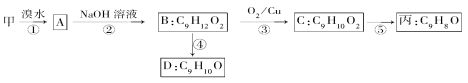
①下列物质不能与B反应的是________(填字母)。
a.金属钠 b.FeCl3 c.碳酸钠溶液 d.HBr
②丙的结构简式为______________。
③D符合下列条件的所有同分异构体________种,任写其中一种能同时满足下列条件的同分异构体结构简式:___________。
a.苯环上的一氯代物有两种 b.遇FeCl3溶液发生显色反应 c.能与Br2/CCl4溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物含量显得尤为重要。
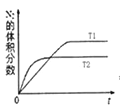
(1)汽车内燃机工作时会引起N2和O2的反应:N2+O2═2NO,是导致汽车尾气中含有NO的原因之一;在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图象判断反应N2(g)+O2(g)═2NO(g)的△H__________ 0(填“>”或“<”)。
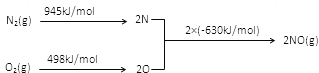
(2)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引起N2和O2反应,其能量变化如图所示,写出该反应的热化学方程式_____________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
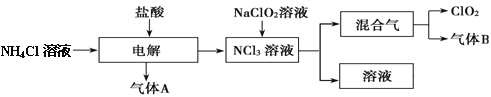
(1)ClO2中所有原子 (填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用 。
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.四氯化碳
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是 。
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备。化学反应方程式为 。
缺点主要是产率低、产品难以分离,还可能污染环境。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是 ,此法相比欧洲方法的优点是 。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为 。此法提高了生产及储存、运输的安全性,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。

(1)A的结构式为______。
(2)B分子中的官能团名称是______,C的名称为______。
(3)写出下列反应的化学方程式:
①__ ___。
③___ ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解饱和食盐水的装置如图所示(a、b为石墨电极,不考虑U形管中气体的溶解且a上产生的气体全部进入小试管中)。
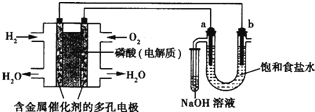
(1)写出通入H2这一极的电极反应_________,通入O2这一极的电极反应为_________。
(2)a为_________极,电极反应为_________ 。
(3)b为_________极,电极反应为_________。
(4)在25℃,当燃料电池中消耗 0.02g H2时,U形管中液体的体积为200mL(忽略实验过程中体积的变化), 求此时U形管中溶液的pH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池(PEMFC) 常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是
①正极反应为:O2+4H++4e- ═2H2O
②负极反应为:2H2-4e- ═4H+
③总的化学反应为:2H2+O2![]() 2H2O
2H2O
④H+通过电解质向正极移动
A.①②③④ B.②③④ C.①②④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组粒子互为同位素的是 (填编号,下同)。互为同素异形体的是 ,互为同分异构体的是 互为同系物的是 。
①16O2和18O3
②质子数相同而中子数不同的两种粒子
③11H、D、T
④3015R和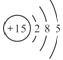 (核内15个中子)
(核内15个中子)
⑤葡萄糖和果糖
⑥
⑦CH3CH2CH2CH2CH2CH3和(CH3)2CHCH(CH3)2
⑧(CH3)2CHCH(CH3)2和C(CH3)4
(2)生活中的一些问题常涉及化学知识,下列叙述正确的是(填序号) 。
①淀粉、蛋白质都是天然有机高分子化合物
②食用植物油的重要成分是高级不饱和脂肪酸甘油酯,是人体的营养物质
③禁止使用含铅汽油是为了提高汽油的燃烧效率
④福尔马林是一种良好的杀毒剂,也可用来消毒自来水
⑤随着人们生活节奏的加快,方便的小包装食品已被广泛接受.为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常放入生石灰
⑥向蛋白质溶液中加入(NH4)2SO4浓溶液,蛋白质会析出,加水后不再溶解
⑦为保证加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉
(3)在实验室生成乙酸乙酯的可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) .
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B═H++HB-;HB-![]() H++B2-,回答下列问题:
H++B2-,回答下列问题:
(1)NaHB溶液显___________(填“酸性”、“中性”或“碱性”或“酸碱性无法确定”),理由是___________。
(2)某温度下,向0.1mol/L的NaHB溶液中滴入0.1mol/LKOH溶液至中性,此时溶液中以下关系一定正确的是___________(填字母).
A.c(H+)c(OH-)═1×10-14 mol2/L2
B.c(Na+)+c(K+)═c(HB-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)═0.05mol/L
(3)已知常温下H2B的钙盐(CaB)饱和溶液中存在以下平衡:CaB(s) ![]() Ca2+(aq)+B2-(aq)△H>0.
Ca2+(aq)+B2-(aq)△H>0.
①温度升高时,Ksp ___________(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)___________,原因是___________(用文字和离子方程式说明)。
(4) 已知0.1molL-1NaHB溶液的pH=2,则0.1molL-1H2B溶液中氢离子的物质的量浓度可能是___________0.11molL-1(填“<”、“>”、或“=”); 理由是___________。
(5)0.1 mol/L NaHB溶液中各种离子浓度由大到小的顺序是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com