
【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | ||||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
请按要求回答下列问题。
(1)元素⑧的名称是______,元素⑧在周期表中所处位置___________。元素④的氢化物沸点高于⑦的氢化物沸点,原因是_________________________________________。
(2)④⑥⑦的氢化物按稳定性由弱到强的顺序是________________________(写氢化物的化学式)。
(3)元素②④形成原子个数比为1:2的化合物的电子式是 。
(4)元素②形成的一类氢化物称为烷烃,通式是___________,其中 (填分子式)有两种同分异构体,结构简式分别是____________________________________。
(5)用电子式表示⑤与⑦形成化合物的过程_________________________。
【答案】(1)氖 第二周期0族 H2O分子间能形成氢键
(2)PH3<H2S<H2O
(3)![]()
(4)CnH2n+2C4H10CH3CH2CH2CH3CH3CH(CH3)CH3
(5)![]()
【解析】试题分析:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为P、⑦为S、⑧为Ne、⑨为Cl。则
(1)⑧的名称是氖,位于第二周期0族;元素④为氧,⑦为S,由于H2O分子间能形成氢键,所以元素④的氢化物沸点高于⑦的氢化物沸点;
(2)同周期自左而右非金属性逐渐增强、同主族自上而下非金属性逐渐减弱,故非金属性O>S>P,非金属性越强,氢化物越稳定,故氢化物稳定性PH3<H2S<H2O;
(3)元素②④形成原子个数比为1:2的化合物为CO2,含有极性键的共价化合物,其电子式为![]() ;
;
(4)元素②形成的一类氢化物称为烷烃,通式是CnH2n+2,其中C4H10有两种同分异构体,即正丁烷和异丁烷,其结构简式分别是CH3CH2CH2CH3、CH3CH(CH3)CH3;
(5)⑤与⑦形成化合物为Na2S,属于离子化合物,由钠离子与硫离子构成,其形成过程为![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】据媒体报道,以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池(PEMFC) 常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是
①正极反应为:O2+4H++4e- ═2H2O
②负极反应为:2H2-4e- ═4H+
③总的化学反应为:2H2+O2![]() 2H2O
2H2O
④H+通过电解质向正极移动
A.①②③④ B.②③④ C.①②④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程脱除燃煤尾气中的SO2,同时制得电池材料MnO2(反应条件已省略)。

请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、 、 ;其中玻璃棒的作用是 。
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是 。
(3)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),溶液中Cu2+的浓度是 mol/L。
(4)工业上采用惰性电极电解K2MnO4水溶液的方法来生产KMnO4,请写出阳极的电极反应式 ,电解总反应的化学方程式 。
(5)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是_________。(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)除杂后得到的MnSO4溶液可以通过 制得硫酸锰晶体。(MnSO4H2O,相对分子质量为169)
a.过滤 b.蒸发浓缩 c.冷却结晶 d.灼烧
(7)已知废气中SO2浓度为8.4 g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000 m3燃煤尾气,可得到硫酸锰晶体质量为 kg(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B═H++HB-;HB-![]() H++B2-,回答下列问题:
H++B2-,回答下列问题:
(1)NaHB溶液显___________(填“酸性”、“中性”或“碱性”或“酸碱性无法确定”),理由是___________。
(2)某温度下,向0.1mol/L的NaHB溶液中滴入0.1mol/LKOH溶液至中性,此时溶液中以下关系一定正确的是___________(填字母).
A.c(H+)c(OH-)═1×10-14 mol2/L2
B.c(Na+)+c(K+)═c(HB-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)═0.05mol/L
(3)已知常温下H2B的钙盐(CaB)饱和溶液中存在以下平衡:CaB(s) ![]() Ca2+(aq)+B2-(aq)△H>0.
Ca2+(aq)+B2-(aq)△H>0.
①温度升高时,Ksp ___________(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)___________,原因是___________(用文字和离子方程式说明)。
(4) 已知0.1molL-1NaHB溶液的pH=2,则0.1molL-1H2B溶液中氢离子的物质的量浓度可能是___________0.11molL-1(填“<”、“>”、或“=”); 理由是___________。
(5)0.1 mol/L NaHB溶液中各种离子浓度由大到小的顺序是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种新型能源,利用二氧化碳合成新能源已成为环保化学家研究的热门课题。
(1)几种共价键的键能如表所示:
化学键 | C=O | H-H | C-H | C-O | H-O |
键能/kJ·mol-1 | 803 | 436 | 414 | 326 | 464 |
2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ![]() _______________。
_______________。
(2)“人工光合作用”技术备受瞩目,该技术模拟事物的光合作用,利用太阳光将H2O和CO2直接合成燃料和化工原料。科研人员模拟光合作用,设计如图甲所示装置制备二甲醚。能量转化形式为太阳能![]() 电能
电能![]() 化学能、
化学能、
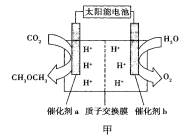
①催化剂b的电极名称是_________________。
②若释放11.2L氧气(标准状况下),有___________mol H+___________(填质子的迁移方向)。
③催化剂a上的电极反应式为______________。
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2的零排放,其基本原理如图乙所示:
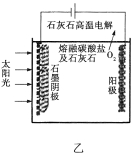
①生产过程中能量的转化形式是__________________。
②电解反应在温度小于900![]() 时进行,碳酸钙分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为_______________,阴极的电极反应式为______________。
时进行,碳酸钙分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为_______________,阴极的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | t1 |
E | 2 | 颗粒 | 15 | t2 |
F | 2 | 粉末 | 15 | t3 |
G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(1)反应的离子方程式是 ,该反应为 反应(填“放热”或“吸热”)。
(2)t1=________s, 完成下列时间对温度的曲线图(纵轴表示时间,横轴表示温度)。
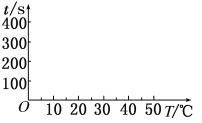
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是__________。
(4)t1______(填“>”或“<”)t4,原因是________________________________。
t2________t3(填“>”或“<”),原因是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己二酸![]() 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酷化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酷化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:![]()
可能用到的有关数据如下:
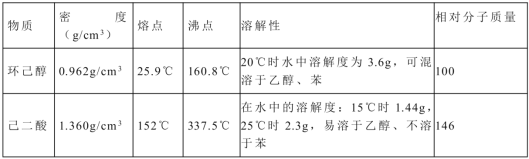
实验步骤如下:
Ⅰ、在三口烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇。
Ⅱ、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65 ℃之间。
Ⅲ、当环己醇全部加入后,将混合物用80℃-90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
Ⅳ、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。
Ⅴ、粗产品经提纯后称重为5.7g。
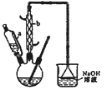
请回答下列问题:
(1)滴液漏斗的细支管a的作用是________,仪器b的名称为________。
(2)己知用NaOH溶液吸收尾气时发生的相关反应方程式为:2NO2+2NaOH=NaNO2 +NaNO3 +H2O
NO+NO2+2NaOH =2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:_________________、__________________;
(3)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则可能造成较严重的后果,试列举一条可能产生的后果:_________________________________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和________洗涤晶体。
(5)粗产品可用________法提纯(填实验操作名称)。本实验所得到的己二酸产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO从右到左通过交换膜移向M极,下列分析正确的是( )
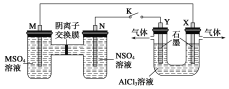
A.溶液中c(M2+)减小
B.N的电极反应式:N-2e-===N2+
C.X电极上有H2产生,发生还原反应
D.反应过程中Y电极周围生成白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.乙烯是是由裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。
下图是石蜡油在炽热碎瓷片的作用下产生乙烯并检验其性质的实验,完成下列问题。
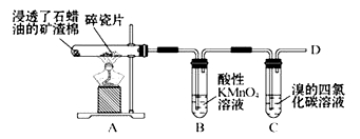
(1)A中碎瓷片的作用是 。
(2)B中反应类型是 。C中实验现象是 。
II.现有CH4、C2H4、C6H6三种有机化合物:
(3)等质量的以上物质完全燃烧时耗去O2的量最多的是__________。生成二氧化碳最多的是__________,生成水最多的是_________。
III.(4)分子式为C9H12的苯的同系物有 种,若在苯环上发生硝化反应时,生成的一硝基取代物只有一种,该烃的结构简式为 。
(5)分子中含有22 个共价键的烷烃,烷烃的分子式: 。
(6)支链只有一个乙基且式量最小的烷烃的结构简式 ,其名称为 。
(7)将某种烷烃进行氯代反应,测出一氯代物有4 种。3.6g 该烃完全生成一氯代物时,放出的气体用蒸馏水完全吸收,所得溶液用0.1 mol·L-1NaOH 溶液500mL恰好中和。则此烷烃的分子式为 ,其结构简式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com