
����Ŀ����ͼ��ʾ���ܸ�AB���˷ֱ���������ͬ��������ͬ�Ŀ���ͭ��Ϳ��������ڸܸ�ʹ����ˮ�б���ƽ�⣬Ȼ��С�ĵ����ձ��������ŨCuSO4��Һ��һ��ʱ��������йظܸ˵�ƫ���ж���ȷ����(ʵ������в�������˿��Ӧ�����߸����ı仯) �� ��

A. �ܸ�Ϊ����;�Ե��ʱ����ΪA�˸�B�˵�
B. �ܸ�Ϊ����;�Ե��ʱ����ΪA�˵�B�˸�
C. ���ܸ�Ϊ��Ե��ʱ��A�˵�B�˸ߣ�Ϊ����ʱ��A�˸�B�˵�
D. ���ܸ�Ϊ��Ե��ʱ��A�˸�B�˵ͣ�Ϊ����ʱ��A�˵�B�˸�
���𰸡�D
��������
�ܸ�Ϊ����ʱ�����ձ��������ŨCuSO4��Һ������Fe��Cuԭ��أ����ܸ�Ϊ��Ե��ʱ��ֻ����Fe������ͭ��Һ�ķ�Ӧ���Դ������
�ܸ�Ϊ����ʱ�����ձ��������ŨCuSO4��Һ������Fe��Cuԭ��أ�FeΪ����������Fe-2e-�TFe2+��CuΪ����������Cu2++2e-�TCu����A�˵ͣ�B�˸ߣ�
�ܸ�Ϊ��Ե��ʱ��ֻ����Fe������ͭ��Һ�ķ�Ӧ����Fe�ı��渽��Cu�����������A�˸ߣ�B�˵ͣ�
��ѡD��


 ����Ӣ��ϵ�д�
����Ӣ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�̶��ݻ����ܱ������н��з�Ӧ��2SO2(g)��O2(g)![]() 2SO3(g)����֪��Ӧ������ijһʱ��SO2��O2��SO3��Ũ�ȷֱ�Ϊ0.2 mol/L,0.1 mol/L,0.2 mol/L, ����Ӧ�ﵽƽ��ʱ�����ܴ��ڵ�������(����)
2SO3(g)����֪��Ӧ������ijһʱ��SO2��O2��SO3��Ũ�ȷֱ�Ϊ0.2 mol/L,0.1 mol/L,0.2 mol/L, ����Ӧ�ﵽƽ��ʱ�����ܴ��ڵ�������(����)
A. SO2Ϊ0.4 mol/L��O2Ϊ 0.2 mol/L
B. SO2Ϊ0.25 mol/L
C. SO2��SO3��Ϊ0.15 mol/L
D. SO3Ϊ0.4 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I. ���Ȼ�����ͭ(Cu)˵�������㲻���ã����һ��ǻ�����㡣
(1)д��FeCl3��Һ����ͭ������ӷ���ʽ��______________________��
(2)����(1)�еķ�Ӧ��Ƴ�ԭ��أ�д���缫��Ӧʽ��
������Ӧ�� _________________________________________��
������Ӧ��__________________________________________��
II. �мס�����λͬѧ��������ԭ��ط�Ӧ�������Ļ��˳�����˾���þƬ����Ƭ���缫������ͬѧ���缫����6 mol/L��H2SO4��Һ�У���ͬѧ���缫����6 mol/L��NaOH��Һ�У���ͼ��ʾ��
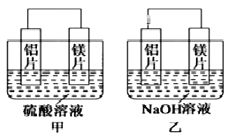
(1)����SO42-����____(������Ƭ������þƬ��)��д�����������ĵ缫��Ӧʽ__________��
(2)���и���Ϊ______(������Ƭ������þƬ��)�ܷ�Ӧ�����ӷ���ʽ��__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ѧ��ӦA2(g)+B2(g)��2AB(g)�������仯��ͼ��ʾ���ж�������������ȷ���ǣ� ��
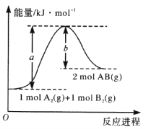
A. ÿ����2 mol AB����bkJ����
B. �÷�Ӧ����H= + (a-b)kJ mol-1
C. �÷�Ӧ�з�Ӧ��������������������������
D. ����1 mol A��A��1 mol B��B�����ų�akJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС�鹹�뽫����β����NO��NO2��ת��Ϊ��Ҫ�Ļ���ԭ��HNO3����ԭ����ͼ��ʾ������A��BΪ��ײ���.����˵����ȷ����
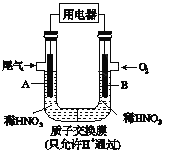
A. �缫A���淴Ӧ֮һΪNO2��e��+H2O= NO3_+2H+
B. �缫B������c(NO3_)����
C. �������Һ�е����ķ�����B��A�����ӵ�������֮�෴
D. �õ�ع���ʱ��ÿת��4mol���ӣ�����22.4L O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CuSO4��Һ�м���H2O2��Һ���ܿ��д��������ݳ���ͬʱ���ȣ�һ��ʱ�����ɫ��Һ��Ϊ��ɫ����(Cu2O)����������H2O2��Һ����ɫ�����ֱ�Ϊ��ɫ��Һ�������Ӧ���Է�����Ρ����й����������̵�˵������ȷ����
A. Cu2+��H2O2�ֽⷴӦ�Ĵ��� B. H2O2ֻ������������
C. H2O2�ĵ���ʽΪ: ![]() D. �����˷�ӦCu2O + H2O2+4H+=2Cu2++3H2O
D. �����˷�ӦCu2O + H2O2+4H+=2Cu2++3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ�ý���ʵ�飬��Һ��A��μ��뵽����B�У��� ����������ȷ����(����)

A. ��AΪŨ���ᣬBΪKMnO4��C��ʢƷ����Һ����C����Һ��ɫ
B. ��AΪ���ᣬBΪ���ǣ�C��ʢNa2SiO3����C����Һ�б����
C. ��AΪŨ��ˮ��BΪ��ʯ�ң�C��ʢAlCl3��Һ����C���Ȳ�����ɫ������������ܽ�
D. ʵ������D������ֹ��Һ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ���еķ�������ǻ�ѧ��Ӧԭ����Ҫ�о���������Ҫ���⣬�����йػ�ѧ��
Ӧ���еķ�����ȵ�˵������ȷ���ǣ� ��
A. mA(g)+nB(g)![]() pC(g)��ƽ��ʱA��Ũ�ȵ���0.5 mol/L���������������һ�����ﵽ�µ�ƽ���A��Ũ�ȱ�Ϊ0.3mol/L���������m+n��p
pC(g)��ƽ��ʱA��Ũ�ȵ���0.5 mol/L���������������һ�����ﵽ�µ�ƽ���A��Ũ�ȱ�Ϊ0.3mol/L���������m+n��p
B. ��һ���������İ�������������ܱ���պ��������У��ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4(s)![]() 2NH3(g)��CO2(g)����CO2�����������������Ϊƽ���жϵ�����
2NH3(g)��CO2(g)����CO2�����������������Ϊƽ���жϵ�����
C. ���ڷ�ӦA(g)+B(g)![]() 2C(g)����ʼ��������ʵ�����A��B���ﵽƽ��ʱA���������Ϊn������ʱ������ϵ��ѹ��A�������������
2C(g)����ʼ��������ʵ�����A��B���ﵽƽ��ʱA���������Ϊn������ʱ������ϵ��ѹ��A�������������
D. 2NO(g)��2CO(g)��N2(g)��2CO2(g)�ڳ��������Է����У���÷�Ӧ�Ħ�H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.1mol Na2CO3�����������õ�һ�����Ϊ1L����Һ����Һ�в�������pH�Ĺ�ϵ��ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ������ȷ����

A. W����ʾ����Һ�У�c(Na+)>c(CO32-)= c(HCO3-)>c(OH-)>c(H+)
B. pH=4����Һ�У�c(H2CO3)+c(HCO3-)+ c(CO32-)=0.1mol/L
C. pH=8����Һ�У�c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D. pH=11����Һ�У�c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CO32-)+c(HCO3-)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com