
【题目】I. 三氯化铁对铜(Cu)说:尽管你不活泼,但我还是会包溶你。
(1)写出FeCl3溶液包溶铜板的离子方程式:______________________。
(2)若将(1)中的反应设计成原电池,写出电极反应式。
正极反应: _________________________________________;
负极反应:__________________________________________。
II. 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol/L的H2SO4溶液中,乙同学将电极放入6 mol/L的NaOH溶液中,如图所示。
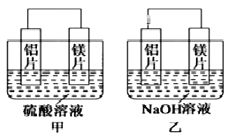
(1)甲中SO42-移向____(填“铝片”或“镁片”),写出甲中正极的电极反应式__________。
(2)乙中负极为______(填“铝片”或“镁片”)总反应的离子方程式:__________________。
【答案】2Fe3++Cu=2Fe2++Cu2+ Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+) Cu-2e-=Cu2+ 镁片 2H++2e-=H2↑ 铝片 2Al+2H2O+2OH-=2AlO2-+3H2↑
【解析】
I. (1) FeCl3溶液腐蚀印刷电路铜板,生成氯化铜、氯化亚铁;
(2)原电池的构成条件:自发的氧化还原反应,在原电池的负极上发生失电子的氧化反应,正极上是还原反应,据氧化还原反应确定电解质溶液;
II.甲同学依据的化学反应原理是Mg+H2SO4=MgSO4+H2↑,乙同学依据的化学反应原理是2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由于Al显两性,与酸碱都能发生反应。
(1)甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应,溶液中离子移动方向可根据同种电荷相互排斥,异种电荷相互吸引的原则分析;
(2)乙池中铝易失电子作负极、镁作正极。
I.(1) FeCl3溶液包溶铜板的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;
(2)原电池的构成条件:自发的氧化还原反应,据此确定电解质溶液,在原电池的石墨为正极,该电极上发生的电子的还原反应,即2Fe3++Cu═2Fe2++Cu2+;负极上发生失电子的氧化反应,该反应为Cu-2e-=Cu2+,电解质是FeCl3溶液;
II.(1)甲用Mg与H2SO4发生反应,总反应方程式为Mg+2H+=Mg2++ H2↑,Mg失去电子,发生氧化反应,作负极,电极反应式为Mg-2e-=Mg2+,负极附近溶液中阳离子浓度大,所以溶液中带负电荷的SO42-向负极镁片移动;在正极上,溶液中的H+获得电子,变为H2逸出,正极的电极反应式为2H++2e-=H2↑;
(2)在乙中,由于Mg不能与NaOH溶液发生反应,Al能够发生反应,所以Al为负极,失去电子,发生氧化反应,Mg为正极,正极上发生还原反应,总反应的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】X + 的核外电子排布为 2、8、8,则X位于周期表的位置是( )
A. 第四周期第 IA 族 B. 第三周期第 0 族
C. 第三周期第 IA 族 D. 第三周期第 VIIA 族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1所示是某些物质的转化关系图(部分小分子产物没有标出)。

已知:
I.A、B、C是三种常见的气态含碳化合物,A、B的相对分子质量均为28,C的相对分子质量略小于A。
II.化合物D的比例模型如图2所示。
III.硫酸氢乙酯水解得E与硫酸。
V.E与F反应,得一种有浓郁香味的油状液体G,E与D反应得无色液体H。
请按要求回答下列问题:
(1)化合物D所含官能团的名称是______,化合物C的结构简式为__________。
(2)化合物A与F在一定条件下也可发生类似①的反应,其化学方程式为___________。
(3)下列说法正确的是___________。
A.反应①的反应类型是加成反应
B.化合物H可进一步聚合成某种高分子化合物
C.在反应②、③中,参与反应的官能团不完全相同
D.从A经硫酸氢乙酯至E的反应中,硫酸实际起到了催化剂的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】14CuSO4+5FeS2+12H2O =7Cu2S+5FeSO4+12H2SO4说法不正确的是( )
A. Cu2S是还原产物B. 产物中的SO42-有一部分是氧化产物
C. CuSO4是氧化剂,FeS2是还原剂D. 5mol FeS2发生反应,有![]() 21mol 转移
21mol 转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是____________。
(2)步骤Ⅱ吸收Br2,有关反应的化学方程式为___________________________,由此反应可知,除环境保护外,在工业生产中还应解决的主要问题是_________________。
(3)某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了装置简图:

请你参与分析讨论:
①图中仪器B的名称是____________________。
②实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下对比不正确的是
A. 热稳定性:H2O>H2S B. 原子半径:Na>Mg
C. 阴离子的还原性:I->Cl- D. 失电子能力:Na > K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化) ( )

A. 杠杆为导体和绝缘体时,均为A端高B端低
B. 杠杆为导体和绝缘体时,均为A端低B端高
C. 当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D. 当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年我国大面积发生雾霾天气,2.5微米以下的细颗粒物(PM2.5)是导致雾霾天气的“罪魁祸首”。空气中的CO、SO2、NOx等污染气体会通过大气化学反应生成PM2.5颗粒物。
(1)已知:2C(s)+O2(g)![]() 2CO(g) ΔH1= -221.0 kJ/mol
2CO(g) ΔH1= -221.0 kJ/mol
N2(g)+O2(g)![]() 2NO (g) ΔH2= +180.5 kJ/mol
2NO (g) ΔH2= +180.5 kJ/mol
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH3= -746.0 kJ/mol
2CO2(g)+N2(g) ΔH3= -746.0 kJ/mol
用焦炭还原NO生成无污染气体的热化学方程式为_________________________________。
(2)已知由CO生成CO2的化学方程式为CO+O2![]() CO2+O 。其正反应速率为v正=k正·c(CO) ·c(O2),逆反应速率为v逆=k逆·c(CO2) ·c(O),k正、k逆为速率常数。在2500 K下,k正=1.21×105 L·s-1·mol-1,k逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为_________________________(保留小数点后一位小数)。
CO2+O 。其正反应速率为v正=k正·c(CO) ·c(O2),逆反应速率为v逆=k逆·c(CO2) ·c(O),k正、k逆为速率常数。在2500 K下,k正=1.21×105 L·s-1·mol-1,k逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为_________________________(保留小数点后一位小数)。
(3)CO2可用来生产燃料甲醇。CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
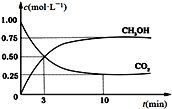
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________________ mol·(L·min) -1。
②氢气的转化率=________________________。
③下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
A.升高温度 B.充入0.5 mol CO2 和1.5 mol H2
C.充入He(g),使体系压强增大 D.将H2O(g)从体系中分离出去
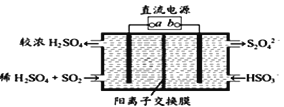
(4)利用如图所示电解装置(电极均为惰性电极)可吸收SO2,并用阴极室排出的溶液吸收NO2 。与电源b极连接的电极的电极反应式为____________________________________。
(5)NO2在一定条件下可转化为NH4NO3和NH4NO2。相同温度下,等浓度NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,分析可能的原因________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com