
【题目】14CuSO4+5FeS2+12H2O =7Cu2S+5FeSO4+12H2SO4说法不正确的是( )
A. Cu2S是还原产物B. 产物中的SO42-有一部分是氧化产物
C. CuSO4是氧化剂,FeS2是还原剂D. 5mol FeS2发生反应,有![]() 21mol 转移
21mol 转移
【答案】C
【解析】
A.CuSO4→Cu2S,Cu元素化合价降低,S元素化合价降低,则Cu2S是还原产物,A正确;
B.由化学方程式可知,反应物中含有14molSO42-离子,生成物中有17molSO42-离子,则有3molS被氧化,B正确;
C.FeS2中S元素化合价为-1价,反应后分别升高为+6价、降低为-2价,FeS2既是氧化剂又是还原剂,C错误;
D.5molFeS2发生反应,Cu元素化合价由+2价→+1价,14molCuSO4得到14mol电子,FeS2→Cu2S,S元素的化合价由-1价→-2价,生成7molCu2S,得到7mol电子,有21mol电子转移,D正确;
故合理选项是C。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列对SO2的性质描述不正确的是( )
A. 无色、有刺激性气味的气体 B. 和水反应生成硫酸
C. 能使品红溶液褪色 D. 有还原性,能被氧气氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L,0.1 mol/L,0.2 mol/L, 当反应达到平衡时,可能存在的数据是( )
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L,0.1 mol/L,0.2 mol/L, 当反应达到平衡时,可能存在的数据是( )
A. SO2为0.4 mol/L,O2为 0.2 mol/L
B. SO2为0.25 mol/L
C. SO2、SO3均为0.15 mol/L
D. SO3为0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) ⊿H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应⊿H1、⊿H2、⊿H3的关系正确的是( )
A. ⊿H1>⊿H2>⊿H3 B. ⊿H1<⊿H3<⊿H2 C. ⊿H1<⊿H2<⊿H3 D. ⊿H1>⊿H3>⊿H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油铁储罐久置未清洗易引发火灾,经分析研究,事故由罐体内壁附着的氧化物甲与溶于石油中的气态氢化物乙按1:3反应生成的黑色物质丙自燃引起。某研究小组按照以下流程对粉末丙进行研究:
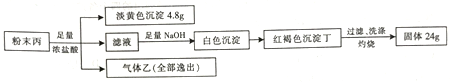
已知:气体乙可溶于水,标准状况下的密度为1.52g/L。
请回答下列问题:
(1)化合物甲的化学式为___________。
(2)化合物丙在盐酸中反应的离子方程式:____________。
(3)化合物丁还可用于氧化法制备高铁酸钾(K2FeO4),试写出在KOH存在条件下用次氯酸钾氧化化合物丁制备高铁酸钾的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.请根据有关知识,填写下列空白:
(1)下列反应中,属于吸热反应的是______(填数字序号,下同),属于放热反应的是______。
①煅烧石灰石制生石灰②氢氧化钠固体溶于水 ③碳与水蒸气的反应 ④酸碱中和反应⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)已知H2和O2反应放热,且断开1molH-H、1mo1O=O、1molO-H键需要吸收的能量分别为Q1kJ、Q2kJ、Q3kJ,由此可以推知下列关系正确的是______(填字母编号)。
A. Q1+ Q2> Q3 B. 2Q1+ Q2<4 Q3 C. Q1+Q2>2Q3 D. 2Q1+Q2<2Q3
II.下列物质:①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧ I2
(1)只存在非极性键的是_____(用序号填空,下同)
(2)既含有共价键又含有离子键的是______________.
(3)当其熔化时,不破坏化学键的是______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 三氯化铁对铜(Cu)说:尽管你不活泼,但我还是会包溶你。
(1)写出FeCl3溶液包溶铜板的离子方程式:______________________。
(2)若将(1)中的反应设计成原电池,写出电极反应式。
正极反应: _________________________________________;
负极反应:__________________________________________。
II. 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol/L的H2SO4溶液中,乙同学将电极放入6 mol/L的NaOH溶液中,如图所示。
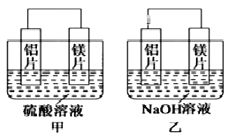
(1)甲中SO42-移向____(填“铝片”或“镁片”),写出甲中正极的电极反应式__________。
(2)乙中负极为______(填“铝片”或“镁片”)总反应的离子方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
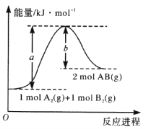
A. 每生成2 mol AB吸收bkJ热量
B. 该反应热△H= + (a-b)kJ mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应进行的方向和限度是化学反应原理所要研究的两个重要问题,下列有关化学反
应进行的方向和限度的说法中正确的是( )
A. mA(g)+nB(g)![]() pC(g),平衡时A的浓度等于0.5 mol/L,将容器体积扩大一倍,达到新的平衡后A的浓度变为0.3mol/L,则计量数m+n<p
pC(g),平衡时A的浓度等于0.5 mol/L,将容器体积扩大一倍,达到新的平衡后A的浓度变为0.3mol/L,则计量数m+n<p
B. 将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中,在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),则CO2的体积分数不变能作为平衡判断的依据
2NH3(g)+CO2(g),则CO2的体积分数不变能作为平衡判断的依据
C. 对于反应A(g)+B(g)![]() 2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压则A的体积分数不变
2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压则A的体积分数不变
D. 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com