
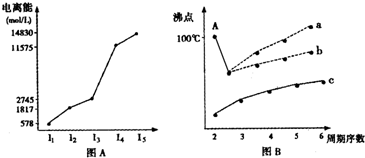
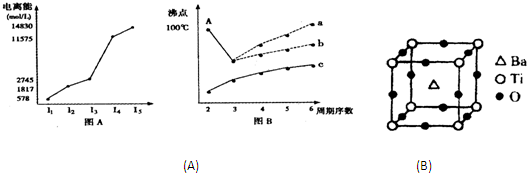
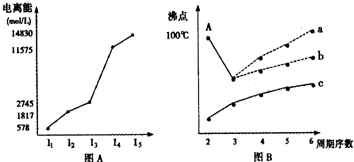
 图表法、图象法是常用的科学研究方法.
图表法、图象法是常用的科学研究方法.| 元 素 | I1/eV | I2/eV | I3/eV |
| L | 13.0 | 23.9 | 40.0 |
| M | 4.3 | 31.9 | 47.8 |
| N | 5.7 | 47.4 | 71.8 |
| O | 7.7 | 15.1 | 80.3 |
| P | 21.6 | 41.1 | 65.2 |
| 13 |
| 16 |
| 13 |
| 16 |
| 13 |
| 16 |
| △n |
| V△t |
| 0.2mol |
| 5L2min |
| 13 |
| 16 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |  |
 |
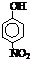 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 2 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
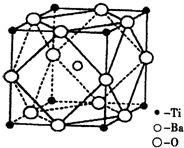
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 性质 |
A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com