
以下是一些物质的熔沸点数据(常压):
| | 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
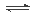 2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol
2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol
(1)0.0015 mol/(L ·min)(2分)
(2)增大压强加快反应速率,反应向正反应方向移动(2分);
(3)3Na2O(s)+C(s,金刚石) = 4Na(g)+Na2CO3(l)△H= —4.2kJ/mol(2分);
(4)O2+2H2O+4e- =4OH-(2分);
(5)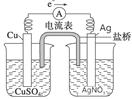 (2分)
(2分)
解析试题分析:(1)先根据定义式求v(Na),再根据速率之比等于化学方程式中的系数之比求v(CO2),即v(Na) =0.0020mol/(L?min), v(CO2)="3" v(Na)/4=0.0015mol/(L?min);(2)增大压强加快反应速率,反应向正反应方向移动;(3)将已知两个热化学方程式编号为①②,①—②×3可以约去3 CO2(g),根据盖斯定律,则6Na2O(s)+2C(s,金刚石)=8Na(g)+2Na2CO3(l) △H=—8.4kJ/mol,若系数减半,则焓变也减半,则3Na2O(s)+ C(s,金刚石)=4Na(g)+Na2CO3(l) △H=—4.2kJ/mol;(4)若K接M,则该装置为原电池,模拟铝的吸氧腐蚀,由于铝比石墨活泼,则铝是负极,石墨是正极,负极反应式为Al—3e—=Al3+,正极反应式为O2+4e—+2H2O=4OH—;(5)验证Cu2+、Ag+氧化性的强弱,可根据置换反应:
Cu+2Ag+=Cu2++2Ag来设计原电池,铜发生氧化反应,银离子发生还原反应。所以铜作负极,银作正极,硫酸铜和硝酸银作电解质溶液。
考点:考查化学反应速率、化学平衡、电化学等相关知识。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:填空题
已知:H2A的A2-可表示S2-、SO42—、SO32—、SiO32—或CO32—。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空: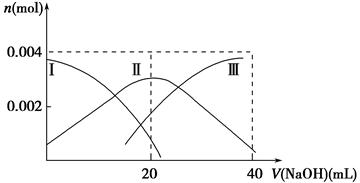
①当V(NaOH)=20 mL时,溶液中离子浓度大小关系:________。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水________(填“大”、“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入_______________________________________________________。
(2)有关H2A的钠盐的热化学方程式如下:
①Na2SO4(s)=Na2S(s)+2O2(g) ΔH1=+1 011.0 kJ·mol-1
②2C(s)+O2(g)=2CO(g) ΔH2=-221.0 kJ·mol-1
则反应③Na2SO4(s)+4C(s)=Na2S(s)+4CO(g) ΔH3=________ kJ·mol-1。工业上制备Na2S时往往还要加入过量的碳,同时还要通入空气,目的有两个,其一是利用碳与氧气反应放出的热,维持反应③所需温度;其二是________________________________________。
(3)若H2A为硫酸:t ℃时,pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW=________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+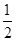 O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+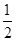 O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
该反应的平衡常数表达式为K= 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 (选填序号)。
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)为了减少空气中的CO2,目前捕碳技术在降低温室气体排放中具有重要的作用,捕碳剂常用(NH4)2CO3,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图,则: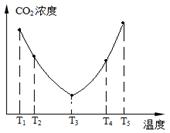
①ΔH3 0(填“>”、“=”或“<”)。
②在T4~T5这个温度区间,容器内CO2气体浓度变化趋势的原因是: 。
(3)催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则反应离子方程式为: 。
②电化学降解NO3-的原理如图,电源正极为: (选填填“A”或“B”),阴极反应式为: 。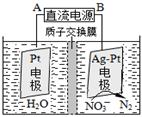
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
(1)上述3种气体直接排入空气后会引起酸雨的气体有 (填化学式)。
(2)早期人们曾经使用铅室法生产硫酸,其主要反应为:
SO2(g)+NO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
①若已知2SO2(g)+O2(g) 2SO3(g) ΔH=a kJ·mol-1
2SO3(g) ΔH=a kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=b kJ·mol-1
2NO2(g) ΔH=b kJ·mol-1
则SO2(g)+NO2(g) SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。
②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应:SO2(g)+NO2(g) SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
a.体系压强保持不变 b.混合气体的颜色保持不变
c.NO的物质的量保持不变 d.每生成1 mol SO3的同时消耗1 mol NO2
③测得②中反应5 min末到达平衡,此时容器中NO与NO2的体积比为3︰1,则这段时间内SO2的反应速率υ(SO2)= ,此反应在该温度下的平衡常数K= 。
(3)甲醇日趋成为重要的有机燃料,通常利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g) CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
①上述合成甲醇的反应为 反应(填“放热”或“吸热”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 。
③若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为 ,理论上通过外电路的电子最多为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应(均为可逆反应):
①CO(g)+ 2H2(g) = CH3OH(g) △H1=—90.1 kJ·mol-1
②CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g) △H2=—49.0 kJ·mol-1
水煤气变换反应③CO(g) + H2O (g)=CO2(g)+H2(g) △H3=—41.1 kJ·mol-1
二甲醚合成反应④2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=—24.5 kJ·mol-1
(1)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。
(2)一定温度下,在恒容密闭容器中进行反应①,下列描述能说明反应到达平衡状态的是 。
a.容器中气体平均相对分子质量保持不变
b.容器中气体密度保持不变
c.CH3OH(g)浓度保持不变
d.CH3OH(g)的消耗速率等于H2 (g)的消耗速率
(3)一定温度下,将8mol CH3OH(g)充入5L密闭容器中进行反应④,一段时间后到达平衡状态,反应过程中共放出49kJ热量,则CH3OH(g)的平衡转化率为 ,该温度下,平衡常数K= ;该温度下,向容器中再充入2mol CH3OH(g),对再次达到的平衡状态的判断正确的是 。
a.CH3OH(g)的平衡转化率减小
b.CH3OCH3 (g)的体积分数增大
c.H2O(g)浓度为0.5mol·L-1
d.容器中的压强变为原来的1.25倍
(4)二甲醚—氧气燃料电池具有启动快,效率高等优点,其能量密度高于甲醇燃料电池,若电解质为酸性,二甲醚—氧气燃料电池的负极反应为 ;消耗2.8L(标准状况)氧气时,理论上流经外电路的电子 mol
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应(均为可逆反应):
①CO(g)+ 2H2(g) = CH3OH(g) △H1=—90.1 kJ·mol-1
②CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g) △H2=—49.0 kJ·mol-1
水煤气变换反应③CO(g) + H2O (g)=CO2(g)+H2(g) △H3=—41.1 kJ·mol-1
二甲醚合成反应④2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=—24.5 kJ·mol-1
(1)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。
(2)一定温度下,在恒容密闭容器中进行反应①,下列描述能说明反应到达平衡状态的是 。
a.容器中气体平均相对分子质量保持不变
b.容器中气体密度保持不变
c.CH3OH(g)浓度保持不变
d.CH3OH(g)的消耗速率等于H2 (g)的消耗速率
(3)一定温度下,将8mol CH3OH(g)充入5L密闭容器中进行反应④,一段时间后到达平衡状态,反应过程中共放出49kJ热量,则CH3OH(g)的平衡转化率为 ,该温度下,平衡常数K= ;该温度下,向容器中再充入2mol CH3OH(g),对再次达到的平衡状态的判断正确的是 。
a.CH3OH(g)的平衡转化率减小
b.CH3OCH3 (g)的体积分数增大
c.H2O(g)浓度为0.5mol·L-1
d.容器中的压强变为原来的1.25倍
(4)二甲醚—氧气燃料电池具有启动快,效率高等优点,其能量密度高于甲醇燃料电池,若电解质为酸性,二甲醚—氧气燃料电池的负极反应为 ;消耗2.8L(标准状况)氧气时,理论上流经外电路的电子 mol
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧热的化学方程式为 。
(2)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol
2NH3(g);ΔH=-92.4 kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。图中t1时引起平衡移动的条件可能是 其中表示平衡混合物中NH3的含量最高的一段时间是 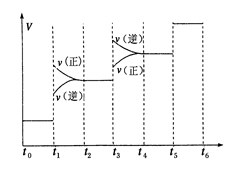
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:①溶液中CrO42—显黄色,Cr2O72-显橙红色
②PbCrO4难溶于水,也难溶于强酸
③H+(aq)+OH-(aq)=H2O(l); ΔH=" —a" KJ/mol
3Cl2(g)+2Cr3+(aq)+16OH-(aq)=2CrO42-(aq)+6Cl-(aq)+8H2O(l);ΔH="—b" KJ/mol
2CrO42-(aq)+2H+(aq)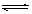 Cr2O72-(aq)+H2O(l);ΔH="—c" KJ/mol
Cr2O72-(aq)+H2O(l);ΔH="—c" KJ/mol
平衡常数K=9.5×104 (上述a、b、c均大于0)
对上述反应⑤,取50mL溶液进行试验,部分测定数据如下:
| 时间(s) | 0 | 0.01 | 0.02 | 0.03 | 0.04 |
| n (CrO42—)(mol) | 0.01 | 8.0×10-4 | 5.4×10-4 | 5.0×10-4 | |
| n (Cr2O72—)(mol) | 0 | | 4.73×10-3 | | 4.75×10-3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com