
����Ŀ��̼���仯����㷺��������Ȼ�硣��ش��������⣺
��1����Ӧ��Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ��H1 ƽ�ⳣ��ΪK1����Ӧ��Fe(s)+H2O(g)
FeO(s)+CO(g) ��H1 ƽ�ⳣ��ΪK1����Ӧ��Fe(s)+H2O(g) ![]() FeO(s)+H2(g) ��H2 ƽ�ⳣ��ΪK2����ͬ�¶��£�K1��K2��ֵ���±���
FeO(s)+H2(g) ��H2 ƽ�ⳣ��ΪK2����ͬ�¶��£�K1��K2��ֵ���±���
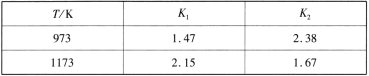
���з�Ӧ��H2(g)+CO2(g) ![]() CO(g)+H2O(g)������ϱ����ݣ���Ӧ����___ (������������������������Ӧ��
CO(g)+H2O(g)������ϱ����ݣ���Ӧ����___ (������������������������Ӧ��
��2����֪CO2������ϳ��Ҵ��ķ�Ӧԭ��Ϊ��2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g) H<0����mΪ��ʼʱ��Ͷ�ϱȣ���m= n(H2)/ n(CO2)��
C2H5OH(g)+3H2O(g) H<0����mΪ��ʼʱ��Ͷ�ϱȣ���m= n(H2)/ n(CO2)��
ͼ1 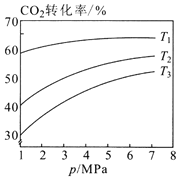 ͼ2
ͼ2 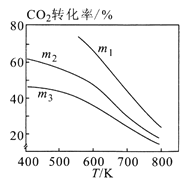 ͼ3
ͼ3 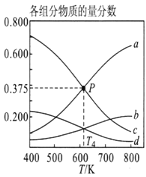
��ͼ1��Ͷ�ϱ���ͬ���¶ȴӸߵ��͵�˳��Ϊ________��
��ͼ2��m1��m2��m3�Ӵ�С��˳��Ϊ________��
��ͼ3��ʾ����ѹΪ5MPa�ĺ�ѹ�����£���m=3ʱ��ƽ��״̬ʱ�����ʵ����ʵ����������¶ȵĹ�ϵ��������d���������ʻ�ѧ����Ϊ__________��
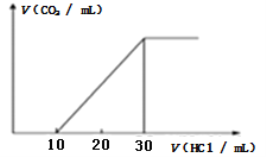
��3��Ϊ�˲���ij��ˮ����̼��������ȡ100mL��ˮ���ữ����N2����CO2������NaOH��Һ���ա�������Һ�еμ�1.0mol/L���ᣬ���ɵ�V(CO2)��V(����)�仯��ϵ��ͼ��ʾ����ԭ����Һ������Ũ���ɴ�С��˳��Ϊ__________��
���𰸡����� ![]()
![]() �Ҵ� c(Na+)> c(HCO3-) > c(CO32-) > c(OH-) > c(H+)
�Ҵ� c(Na+)> c(HCO3-) > c(CO32-) > c(OH-) > c(H+)
��������
��1�����ݸ�˹������д��ȷ���Ȼ�ѧ����ʽ����ϱ����е����ݷ�����Ӧ�ȵı仯��
��2���ٸ÷�ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�������ƶ���ת���ʼ�С��
��һ���¶��£�CO2ת��������ʼʱ��Ͷ�ϱȵ����������һ�ַ�Ӧ��Ũ������������һ�����ʵ�ת���ʣ�
���¶����ߣ���Ӧ������У���ͼ��֪��������aΪH2��bΪCO2��cΪH2O��dΪC2H5OH��
��3������ͼ�������֪����������10mlǰ��δ����CO2��������20ml��������CO2���ݴ��ж���Һ��Ϊ������̼���ƺ�̼�����ƣ���ҺΪ���ԣ��ݴ˷�����Һ������Ũ�ȵĴ�С��ϵ��
��1���ɸ�˹���ɿ�֪����Ӧ��-��Ӧ��ɵ÷�Ӧ��H2(g)+CO2(g) ![]() CO(g)+H2O(g)����H3=��H1-��H2�����ݱ����е����ݿ�֪����Ӧ���¶����ߣ�K����ӦΪ���ȷ�Ӧ����H1>0����Ӧ���¶����ߣ�K��С����ӦΪ���ȷ�Ӧ����H2<0�������H3=��H1-��H2>0��˵����Ӧ��Ϊ���ȷ�Ӧ��
CO(g)+H2O(g)����H3=��H1-��H2�����ݱ����е����ݿ�֪����Ӧ���¶����ߣ�K����ӦΪ���ȷ�Ӧ����H1>0����Ӧ���¶����ߣ�K��С����ӦΪ���ȷ�Ӧ����H2<0�������H3=��H1-��H2>0��˵����Ӧ��Ϊ���ȷ�Ӧ��
��2���ٸ÷�ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�������ƶ���ת���ʼ�С�����T3>T2>T1��
��ͼ3�У���ͬ�¶��£�����H2������ƽ�������ƶ������m1��m2��m3Ͷ�ϱȴӴ�С��˳��Ϊm1>m2>m3��
���¶����ߣ���Ӧ������У���ͼ��֪��������aΪH2��bΪCO2��cΪH2O��dΪC2H5OH��
��3��Ϊ�˲���ij��ˮ����̼��������ȡ100mL��ˮ���ữ����N2����CO2������NaOH��Һ���գ�����ͼ���֪����Һ��Ϊ������̼���ƺ�̼�����ƣ���ҺΪ���ԣ��������Ũ�ȴ�С��ϵΪ��c(Na+)> c(HCO3-) > c(CO32-) > c(OH-) > c(H+)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ����ȷ���ǣ� ��
A.25��ʱ��AgBr��0.0lmol/L��MgBr2��Һ��NaBr��Һ�е��ܽ����ͬ
B.53��ʱ����0.01mol/L�Ĵ�����Һ��ˮ����ϡ�ͣ�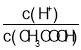 ��С
��С
C.Na2CO3��NaHCO3��Һ��Ũ�ȵ������Ϻ�3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.NaCN��Һ�������ϳ����Ե���Һ�У�c(Na+)>c(Cl-)=c(HCN)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������һ����Ҫ�Ļ���ԭ�ϣ�ͨ���úϳɰ����ϳ�����IJ����������
��1�������ˮ��ҺpH__________7��������������=����������������ˮ��Һ�и�������Ũ�ȴ�С��ϵΪ___________
��2����֪�ϳɰ����Ȼ�ѧ����ʽΪ��N2��g��+ 3H2��g��![]() 2NH3��g����H=��92kJ/mol�����յ��������������ʵ���֮��1��3�ı������ֱ���200�桢400�桢600���������½��з�Ӧ��������NH3�����ʵ���������ѹǿ�ı仯������ͼ��ʾ
2NH3��g����H=��92kJ/mol�����յ��������������ʵ���֮��1��3�ı������ֱ���200�桢400�桢600���������½��з�Ӧ��������NH3�����ʵ���������ѹǿ�ı仯������ͼ��ʾ
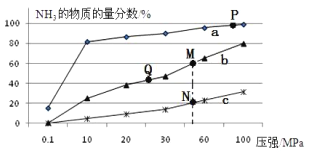
������c��Ӧ���¶�Ϊ___________ ��
������˵������ȷ����___________
A����������Ũ�ȣ��ɴٽ�ƽ�������ƶ�������ߵ�����ת����
B��Q���Ӧ�ķ�Ӧ�����£��������ʵ��Ĵ����������NH3�ڻ�����е����ʵ�������
C��M��N�����ƽ�ⳣ����С��ϵΪ��M��N
D��M��N��Q���㷴Ӧ���ʵĴ�С��ϵΪ��N��M��Q
E��Ϊ�˾����ܶ�ĵõ�NH3��Ӧ��ѡ��P���Ӧ���¶Ⱥ�ѹǿ��Ϊ��������
��3������[CO(NH2)2]��һ�ַdz���Ҫ�ĸ�Ч���ʣ���ҵ����NH3��CO2Ϊԭ���������أ��÷�Ӧʵ��Ϊ������Ӧ��
��һ����2NH3(g)��CO2(g)=H2NCOONH4(s) ��H=��272kJ��mol��1
�ڶ�����H2NCOONH4(s)=CO(NH2)2(s)��H2O(g) ��H=��138kJ��mol��1
д����ҵ����NH3��CO2Ϊԭ�Ϻϳ����ص��Ȼ�ѧ����ʽ��_________________________
��4����������β��������ͨ����������Ϊ��������β�������ռ����������Ϊ������Ⱦ�ij������ʣ���д��������NO��Ӧ�Ļ�ѧ����ʽ__________������1mol������ȫ��Ӧʱ��ת�Ƶ��ӵ���ĿΪ___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ϊ1.0 L���������ܱ������м�����������ͬ��̼�ۣ��ٷֱ����0.1 mol CO2��0.2 mol CO2���ڲ�ͬ�¶��·�ӦCO2(g)��C(s)![]() 2CO(g)�ﵽƽ�⣬ƽ��ʱc(CO2) ���¶ȵı仯��ͼ��ʾ��ͼ�Т������������ϣ�������˵����ȷ����
2CO(g)�ﵽƽ�⣬ƽ��ʱc(CO2) ���¶ȵı仯��ͼ��ʾ��ͼ�Т������������ϣ�������˵����ȷ����
A���÷�Ӧ�Ħ�H��0����S��0
B����ϵ����ѹǿp��p(��)��p(��)
C��ƽ�ⳣ����K(��)��K(��)
D��T1Kʱ������������״̬��v(��)��v(��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���л�������Ľṹ��ʽ�ɽ�һ�����磺![]()
������ĿҪ��ش��������⣺
���л��� ![]() ������������ѧ��Ӧ�Ļ�ѧ����ʽΪ(�ýṹ��ʽ��д)��______��
������������ѧ��Ӧ�Ļ�ѧ����ʽΪ(�ýṹ��ʽ��д)��______��
����-�¹�ϩ�Ľṹ��ʽΪ![]() ��һ���Ӹ��������������巢���ӳɷ�Ӧ�IJ���(ֻ����λ���칹)�����������____�֡�
��һ���Ӹ��������������巢���ӳɷ�Ӧ�IJ���(ֻ����λ���칹)�����������____�֡�
��2�����м����������ʣ�


�� ����������Ķ���ȡ��������__________�֣�������Ķ���ȡ��������__________�֡�
�� ���ڱ��ͻ�����ϩ��˵����ȷ����___________(����ĸ����)��
A .����ʹ����KMnO4��Һ��ɫ
B .������H2�����ӳɷ�Ӧ���������ı��ͻ�����ϩ����H2�����ʵ���֮��Ϊ3:4
C .����̼̼������̼̼˫������ṹ
D .���ܷ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����ͬpH������һԪ����HA��HB��Һ�ֱ��ˮϡ�ͣ���ҺpH���ˮ����仯��������ͼ��ʾ������˵����ȷ����
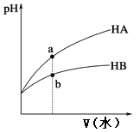
A. HB������ǿ��HA
B. a����Һ�ĵ����Դ���b����Һ
C. ͬŨ�ȵ�NaA��NaB��Һ�У�c(A-)=c(B-)
D. ��ˮϡ�͵�pH��ͬʱ����HA��HB�õ���ˮV(A)С��V(B)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ�����и���������ָ����Һ��һ���ܴ���������ǣ� ��
A.���д���NO3-����Һ��H+��K+��Cl-��Fe2+
B.������Һ��Fe3+��Al3+��NO3-��SO42-
C.![]() =1��10-12����Һ��K+��AlO2-��CO32-��Na+
=1��10-12����Һ��K+��AlO2-��CO32-��Na+
D.��ˮ�������c��H+��=10-12mol/L����Һ��Na+��K+��CO32-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(2013��������ѧ�¿�)���������ʷֱ�װ����ˮ����ƿ��������������U�ιܵ�����������U�ι��ڵ��к�īˮ��ˮ�������ͼ��ʾ״̬����������ʲ�������(�����Ǽ��������������Һ����ı仯)
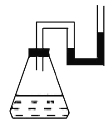
A������NaOH B��ŨH2SO4
C��Ba(OH)2��8H2O��NH4Cl��״�� D��CaO����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ��ѪҺ�еĸ����ӵļ���ܹ������ж϶��ּ�����ij�о�С��Ϊ�ⶨѪҺ��Ʒ��Ca2���ĺ���(100mLѪҺ�к�Ca2��������)��ʵ�鲽�����£�
��ȷ��ȡ5.00mLѪҺ��Ʒ�����������Ƴ�50.00mL��Һ��
��ȷ��ȡ��Һ10.00mL���������(NH4)2C2O4��Һ��ʹCa2����ȫת����CaC2O4������
�۹��˲�ϴ������CaC2O4�������ù���ϡ�����ܽ⣬����H2C2O4��CaSO4ϡ��Һ��
�ܼ���12.00mL0.0010mol��L��1��KMnO4��Һ��ʹH2C2O4��ȫ�����������ӷ���ʽΪ��2MnO4-��5H2C2O4��6H��=10CO2����2Mn2����8H2O��
����0.0020mol��L-1(NH4)2Fe(SO4)2��Һ�ζ�������KMnO4��Һ������(NH4)2Fe(SO4)2��Һ20.00mL��
��1����֪������CaC2O4��Ksp��2.0��10��9����ʹ�������c(Ca2��)��1.0��10��5mol��L��1��Ӧ������Һ��c(C2O42��)��_____mol��L-1��
��2�����������Mn2�����ɣ�������Ӧ�����ӷ���ʽΪ_____��
��3��������ݵζ�����ʹ��ǰδ�ñ�(NH4)2Fe(SO4)2��Һϴ�ӣ����ѪҺ��Ca2+�ĺ�����____(�ƫ�ߡ�����ƫ�͡����䡱)��
��4������Ѫ����Ca2���ĺ���_____(д���������)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com