
【题目】25℃时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随加水体积变化的曲线如图所示。下列说法正确的是
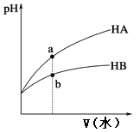
A. HB的酸性强于HA
B. a点溶液的导电性大于b点溶液
C. 同浓度的NaA与NaB溶液中,c(A-)=c(B-)
D. 加水稀释到pH相同时,酸HA、HB用到的水V(A)小于V(B)
【答案】D
【解析】
A.酸性越弱,加水稀释后电离出的氢离子越多,pH越小,故HB的酸性弱于HA,故A不选;
B.溶液的导电性取决于溶液中自由移动离子的浓度。在a、b两点的溶液中都有电荷守恒:c(H+)=c(OH-)+c(A-)和c(H+)=c(OH-)+c(B-)。a点溶液的pH大于b点溶液的PH,所以a点溶液中的c(H+)小于b点溶液中的c(H+),可以推知a点溶液中的离子的总浓度小于b点溶液中的离子的总浓度,所以a点溶液的导电性小于b点溶液的导电性,故B不选;
C.酸的酸性越弱,酸根离子的水解程度越强,故同浓度的NaA与NaB溶液中,c(A-)大于c(B-),故C不选;
D.根据上图可知,稀释到相同pH时,V(A)小于V(B),故D选;
故选D。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】某有机物的键线式如图所示,下列关于该有机物的描述不正确的是
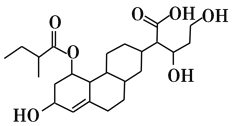
A.含有4种官能团
B.能发生取代、加成、酯化、氧化、还原等反应
C.1mol该物质最多可与3molH2发生加成反应
D.该有机物与Na、NaOH、Na2CO3均能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-二氧六环的一种合成方法如下,下列说法正确的是
CH2=CH2![]()
![]()
![]()
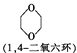
A.反应①、②的原子利用率均为100%
B.反应②的反应类型是加成聚合反应
C.环氧乙烷分子中的所有原子处于同一平面
D.与1,4-二氧六环互为同分异构体的酯类只有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:

已知:Ksp ( Li2CO3)=1.6×10-3 。部分物质的溶解度(S)如下表所示:
T℃ | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g |
20 | 1.33 | 34.2 | 0.039 |
80 | 0.85 | 30.5 | —— |
100 | 0.72 | —— |
(1)从“正极”可以回收的金属有___。
(2)写出碱溶时Al箔溶解的离子方程式___。
(3)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池充电时正极的电极反应式为___。
(4)酸浸时产生标准状况下3.36LNO时,溶解 LiFePO4___mol(其他杂质不与HNO3反应),若用H2O2代替HNO3,发生反应的离子方程式为___。
(5)流程中用“热水洗涤”的原因是___。
(6)若滤液②中c(Li+)=4mol/L,加入等体积的Na2CO3后,Li+的沉降率到90%,计算滤液③中c(CO32-)=___mol/L。
(7)“沉淀”时___(填“能”或“不能”)用Na2SO4溶液代替饱和Na2CO3溶液,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)反应Ⅰ:Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH1 平衡常数为K1,反应Ⅱ:Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1 平衡常数为K1,反应Ⅱ:Fe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH2 平衡常数为K2,不同温度下,K1、K2的值如下表:
FeO(s)+H2(g) ΔH2 平衡常数为K2,不同温度下,K1、K2的值如下表:
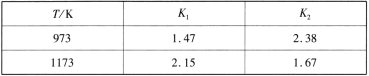
现有反应Ⅲ:H2(g)+CO2(g) ![]() CO(g)+H2O(g),结合上表数据,反应Ⅲ是___ (填“放热”或“吸热”)反应。
CO(g)+H2O(g),结合上表数据,反应Ⅲ是___ (填“放热”或“吸热”)反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g) H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。
C2H5OH(g)+3H2O(g) H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。
图1 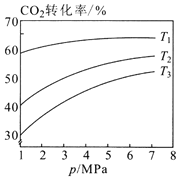 图2
图2 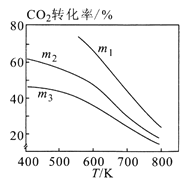 图3
图3 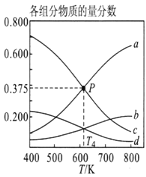
①图1中投料比相同,温度从高到低的顺序为________。
②图2中m1、m2、m3从大到小的顺序为________。
③图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质化学名称为__________。
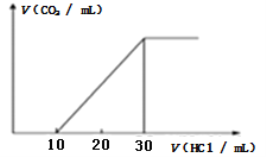
(3)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。往吸收液中滴加1.0mol/L盐酸,生成的V(CO2)随V(盐酸)变化关系如图所示,则原吸收液中离子浓度由大到小的顺序为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在200℃和10MPa的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4和CH3OH的燃烧热分别784kJ/mol和628kJ/mol则2CH4(g)+O2(g)=2CH3OH(g) △H=___。
(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)CH3OCH3(g) +H2O(g) △H<0。
①某温度下,将2.0molCO(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是____。
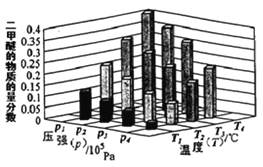
A.P3>P2,T3>T2
B.P1>P3,T1>T3
C.P1>P4,T2>T3
D.P2>P4,T4>T2
②在恒容密闭容器里按体积比为1:3充入一氧化碳和氢 气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是___。
A.氢气的转化率减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g) +N2(g)
2CO2(g) +N2(g)
①200K、pPa时,在一个容积为2L的恒温密闭容器中充入1.5molNO和2.0molCO,开始反应至2min时测得CO转化率为30%,则用N2表示的平均反应速率为υ(N2)=___;反应达到平衡状态时,测得二氧化碳为0.8mol,则平衡时的压强为起始压强的__倍(保留两位小数)。
②该反应在低温下能自发进行,该反应的ΔH__0(填“>”、“<”)
③在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2-t1=t3-t2)则下列说法不正确的是__(填编号)
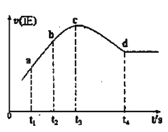
A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:t1~t2 > t2~t3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液是中学化学的重点研究对象。
(1)水是极弱的电解质,也是最重要的溶剂。常温下某电解质溶解在水中后,溶液中的c(H+)=10-9 mol·L-1,则该电解质可能是____(填序号)。
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(2)已知次氯酸是比碳酸还弱的酸,要使新制稀氯水中的c(HClO)增大,可以采取的措施为(回答两种)____,_____。
(3)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,结果溶液均呈中性。
①浓度为1.0×10-3mol·L-1的氨水bL;
②c(OH-)=1.0×10-3mol·L-1的氨水cL;
③c(OH-)=1.0×10-3mol·L-1的氢氧化钡溶液dL
则a、b、c、d之间的大小关系是___。
(4)已知:H2A=H++HA-,HA-![]() H++A2-。常温下,0.1mol·L-1的NaHA溶液其pH=2,则0.1mol·L-1的H2A溶液中氢离子浓度的大小范围是___<c(H+)<___;NaHA溶液中各种离子浓度大小关系为____。
H++A2-。常温下,0.1mol·L-1的NaHA溶液其pH=2,则0.1mol·L-1的H2A溶液中氢离子浓度的大小范围是___<c(H+)<___;NaHA溶液中各种离子浓度大小关系为____。
(5)已知:Ksp(AgCl)=1.8×10-10,向50 mL0.018mol·L-1的AgNO3溶液中加入相同体积0.020mol·L-1的盐酸,所得混合溶液的pH=___,c(Ag+)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )

A. b电极是阴极B. a电极与电源的正极相连
C. 电解过程中水是氧化剂D. b电极附近溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
⑴工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。请结合相关信息,补充完整提纯硝酸锶的下列实验步骤:
①取含杂质的硝酸锶样品,_____,搅拌。
②_____。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH=7~8,过滤。
④将滤液用硝酸调节pH=2~3,_____,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
⑵Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数_________(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com