
����Ŀ�����������������߷��ļ��ڣ���������β����ȼúβ�������������ԭ��֮һ��
��1��ʹ�ü״����Ϳ��Լ�������β���Ի�������Ⱦ����ҵ����200���10MPa�������¿��ü��������ͨ��ͭ�ƹܵ���Ӧ�Ƶü״�����֪һ�������£�CH4��CH3OH��ȼ���ȷֱ�784kJ/mol��628kJ/mol��2CH4(g)+O2(g)=2CH3OH(g) ��H=___��
��2��������Ҳ�������Դ���úϳ����ڴ����������Ʊ������ѵķ�Ӧԭ��Ϊ��2CO(g)+4H2(g)CH3OCH3(g) +H2O(g) ��H<0��
��ij�¶��£���2.0molCO(g)��6.0molH2(g)�����ݻ�Ϊ2L���ܱ������У���Ӧ����ƽ��ʱ���ı�ѹǿ���¶ȣ�ƽ����ϵ��CH3OCH3(g)�����ʵ��������仯�����ͼ��ʾ�������¶Ⱥ�ѹǿ�Ĺ�ϵ�ж���ȷ����____��
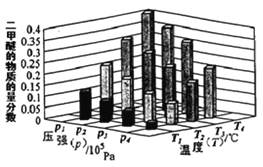
A.P3>P2��T3>T2
B.P1>P3��T1>T3
C.P1>P4��T2>T3
D.P2>P4��T4>T2
���ں����ܱ������ﰴ�����Ϊ1��3����һ����̼���� ����һ�������·�Ӧ�ﵽƽ��״̬�����ı䷴Ӧ��ijһ�����������б仯��˵��ƽ��һ�����淴Ӧ�����ƶ�����___��
A.������ת���ʼ�С B.�淴Ӧ������������С
C.��ѧƽ�ⳣ��Kֵ���� D.��Ӧ�������ٷֺ�������
��3������β����������Ҫԭ��Ϊ��2NO(g)+2CO(g)![]() 2CO2(g) +N2(g)
2CO2(g) +N2(g)
��200K��pPaʱ����һ���ݻ�Ϊ2L�ĺ����ܱ������г���1.5molNO��2.0molCO����ʼ��Ӧ��2minʱ���COת����Ϊ30%������N2��ʾ��ƽ����Ӧ����Ϊ��(N2)=___����Ӧ�ﵽƽ��״̬ʱ����ö�����̼Ϊ0.8mol����ƽ��ʱ��ѹǿΪ��ʼѹǿ��__��(������λС��)��
�ڸ÷�Ӧ�ڵ��������Է����У��÷�Ӧ�Ħ�H__0(����>������<��)
����ijһ���ȡ����ݵ��ܱ������г���һ������NO��CO����������Ӧ���������Ӧ��������ʱ��仯��������ͼ��ʾ(��֪��t2-t1=t3-t2)������˵������ȷ����__(����)
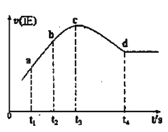
A.��Ӧ��c��δ�ﵽƽ��״̬
B.��Ӧ����a��С��b��
C.��Ӧ��Ũ��a�����b��
D.NO��ת���ʣ�t1~t2 > t2~t3
���𰸡�-312kJ/mol BC BD 0.075mol/(L��min) 0.89 �� D
��������
��1����֪һ�������£�CH4��CH3OH��ȼ���ȷֱ�784kJ/mol��628kJ/mol������CH4(g)+ 2O2(g)=CO2(g)+2H2O(g) ��H1=-784kJ/mol����CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ��H2=-628kJ/mol�����ݸ�˹���ɣ�����2-����2�ɵã�2CH4(g)+O2(g)=2CH3OH(g) ��H= -312kJ/mol��
O2(g)=CO2(g)+2H2O(g) ��H2=-628kJ/mol�����ݸ�˹���ɣ�����2-����2�ɵã�2CH4(g)+O2(g)=2CH3OH(g) ��H= -312kJ/mol��
��2����ͨ��ͼʾ��֪���¶�Խ�߶����ѵ���������ԽС������ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ��������ѵ�������������
��A������Ӧ��Ũ�ȣ�ƽ�������ƶ�������Ӧ������������С��
B���淴Ӧ������������С��˵��ƽ�������ƶ���
C����ѧƽ�ⳣ��Kֵ����˵��ƽ�������ƶ���
D����Ӧ�������ٷֺ�������˵��ƽ�������ƶ���
��3���ٸ���COת���ʼ�������CO���ʵ���������v=![]() ����v��CO�����ٸ�������֮�ȵ��ڻ�ѧ������֮�ȼ���v��N2��������Ŀ��Ϣ��֪��
����v��CO�����ٸ�������֮�ȵ��ڻ�ѧ������֮�ȼ���v��N2��������Ŀ��Ϣ��֪��
��������ʽ��2NO(g)+2CO(g)![]() 2CO2(g) +N2(g)
2CO2(g) +N2(g)
��ʼ(mol) 1.5mol 2.0mol 0 0
�仯(mol) 0.8mol 0.8mol 0.8mol 0.4mol
ƽ��(mol) 0.7mol 1.2mol 0.8mol 0.4mol
�������ʵ���֮��=ѹǿ֮�ȿɵã�ƽ��ʱ��ѹǿ����ʼѹǿ=ƽ��ʱ�����ʵ�������ʼ���ʵ�����
������ӦΪ�������ʵ�����С�ķ�Ӧ��Ϊ�ؼ���Ӧ������H-T��S<0��Ӧ�Է����У�
�۴�t4ʱ������Ӧ���ʲ��䣬����ƽ��״̬��t4ʱ��ǰδ����ƽ�⣬��Ӧ������Ӧ���У��ɢ��п�֪Ϊ��Ӧ�ȷ�Ӧ�����������£��淴Ӧ�����¶����ߣ��¶����������ã���Ӧ���ʼӿ죬����Ũ��Ϊ�������أ���Ӧ���ʼ�����ƽ��״̬��
��1����֪һ�������£�CH4��CH3OH��ȼ���ȷֱ�784kJ/mol��628kJ/mol������CH4(g)+ 2O2(g)=CO2(g)+2H2O(g) ��H1=-784kJ/mol����CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ��H2=-628kJ/mol�����ݸ�˹���ɣ�����2-����2�ɵã�2CH4(g)+O2(g)=2CH3OH(g) ��H= -312kJ/mol��
O2(g)=CO2(g)+2H2O(g) ��H2=-628kJ/mol�����ݸ�˹���ɣ�����2-����2�ɵã�2CH4(g)+O2(g)=2CH3OH(g) ��H= -312kJ/mol��
�ʴ�Ϊ��-312kJ/mol��
��2����2CO(g)+4H2(g) CH3OCH3(g) +H2O(g) ��H<0������Ӧ���ȣ���ͼʾ��֪�¶�Խ�߶����ѵ���������ԽС�����¶ȣ�T1>T2>T3>T4������ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ��������ѵ�������������ѹǿP1>P2>P3>P4��
�ʴ�Ϊ��BC��
��A������Ӧ��Ũ�ȣ�ƽ�������ƶ�������Ӧ������������С����һ�������ƶ�����A����
B���淴Ӧ������������С��˵��ƽ�������ƶ�����B��ȷ��
C����ѧƽ�ⳣ��Kֵ����˵��ƽ�������ƶ�����C����
D����Ӧ�������ٷֺ�������˵��ƽ�������ƶ�����D��ȷ��
�ʴ�ѡBD��
��3��������CO���ʵ���Ϊ2.0mol��30%=0.6mol��v(CO)= =0.15mol/(L��min)������֮�ȵ��ڻ�ѧ������֮�ȣ���v(N2)=
=0.15mol/(L��min)������֮�ȵ��ڻ�ѧ������֮�ȣ���v(N2)=![]() v(CO)=
v(CO)=![]() ��0.15mol/(L��min)=0.075 mol/(L��min)��
��0.15mol/(L��min)=0.075 mol/(L��min)��
��������ʽ��2NO(g)+2CO(g)![]() 2CO2(g) +N2(g)
2CO2(g) +N2(g)
��ʼ(mol) 1.5mol 2.0mol 0 0
�仯(mol) 0.8mol 0.8mol 0.8mol 0.4mol
ƽ��(mol) 0.7mol 1.2mol 0.8mol 0.4mol
�������ʵ���֮��=ѹǿ֮�ȿɵã�ƽ��ʱ��ѹǿ����ʼѹǿ=ƽ��ʱ�����ʵ�������ʼ���ʵ���=![]() = 0.89����ƽ��ʱ��ѹǿΪ��ʼѹǿ��0.89����
= 0.89����ƽ��ʱ��ѹǿΪ��ʼѹǿ��0.89����
�ʴ�Ϊ��0.075 mol/(Lmin)��0.89��
������ӦΪ�������ʵ�����С�ķ�Ӧ��Ϊ�ؼ���Ӧ����S<0������H-T��S<0��Ӧ�Է����У��÷�Ӧ�ڵ��������Է����У��÷�Ӧ����H<0��
�ʴ�Ϊ��<��
�۴�t4ʱ������Ӧ���ʲ��䣬����ƽ��״̬��t4ʱ��ǰδ����ƽ�⣬��Ӧ������Ӧ���У��ɢ��п�֪Ϊ��Ӧ�ȷ�Ӧ�����������£��淴Ӧ�����¶����ߣ��¶����������ã���Ӧ���ʼӿ죬����Ũ��Ϊ�������أ���Ӧ���ʼ�����ƽ��״̬��
A����Ӧ��c��δ�ﵽƽ��״̬����A��ȷ��
B����ͼ��֪����Ӧ����a��С��b�㣬��B��ȷ��
C����Ӧ��Ũ��a�����b�㣬��C��ȷ��
D��NO��ת���ʣ�t1��t2<t2��t3����D����
�ʴ�ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�H2A��һ��������ˮ�Ķ�Ԫ�ᣬ��NaOH��Һ��������ʵ���Ũ�ȵ�H2A��Һ�У���Һ��H2A��HA-��A2-�����ʵ�����������ҺpH�ı仯��ϵ��ͼ��ʾ������˵��������ǣ� ��

A. �����£�H2A�ĵ���ƽ�ⳣ�� Ka1=10-3.30
B. �� c(Na+)=2c(A2-)+c(HA-)ʱ����Һ������
C. pH=6.27ʱ��c(A2-)=c(HA-)��c(H+)��c(OH-)
D. V(NaOH��Һ)��V(H2A��Һ)=3��2 ʱ��2c(Na+)+c(OH-)=2c(H2A)+c(HA-)+c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ѣ�CH3OCH3������Ϊ��21 ���͵����ȼ�ϡ������ü״���ˮ���Ƶö����ѣ���Ӧ����ʽ���£� 2CH3OH(g)![]() CH3OCH3(g) + H2O(g) ��H1
CH3OCH3(g) + H2O(g) ��H1
(1)���������ͨ���ϳ�����Ӧ�Ƶã�����Ȼ�ѧ����ʽ���£�
2H2��g��+ CO��g��![]() CH3OH��g�� ��H2
CH3OH��g�� ��H2
CO��g��+ H2O��g��![]() CO2��g��+ H2(g) ��H3
CO2��g��+ H2(g) ��H3
3H2��g��+ 3CO��g��![]() CH3OCH3��g��+ CO2 (g) ��H4
CH3OCH3��g��+ CO2 (g) ��H4
����H1�� ________���ú�����H2����H3����H4�Ĺ�ϵʽ��ʾ����
(2)���������ϣ�������Ӧƽ��״̬�� Kp �ļ���ʽΪ:![]() ��Kp Ϊ�Է�ѹ��ʾ��ƽ�ⳣ����T Ϊ����ѧ�¶ȣ����Ҵ������� H2O(g)��������ѹǿӰ�죬�Ӷ���һ��Ӱ���Ч�ʡ�)
��Kp Ϊ�Է�ѹ��ʾ��ƽ�ⳣ����T Ϊ����ѧ�¶ȣ����Ҵ������� H2O(g)��������ѹǿӰ�죬�Ӷ���һ��Ӱ���Ч�ʡ�)
����һ���¶ȷ�Χ�ڣ����¶����ߣ�CH3OH(g)��ˮת��Ϊ�����ѵ�����_______ ������������䡱��С������
��ij�¶��£���ʱ Kp=100�������ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵķ�ѹ���£�
���� | CH3OH | CH3OCH3 | H2O |
��ѹ/MPa | 0.50 | 0.50 | 0.50 |
��ʱ�����淴Ӧ���ʵĴ�С��v�� ____v�� ��������� ��������������
��200��ʱ�����ܱ������м���һ�����״� CH3OH����Ӧ����ƽ��״̬ʱ����ϵ��CH3OCH3(g)�����ʵ�������Ϊ _______�����ţ���
A����![]() B��
B��![]() C��
C��![]() ~
~![]() D��
D��![]() E����
E����![]()
��300��ʱ��ʹ CH3OH(g)��һ������ͨ��������V/F (��ԭ�����ʵĴ�����)��ѹǿ�Լ״�ת����Ӱ����ͼ1��ʾ������ͼ״�ת������ѹǿ��ѹ�����仯�Ĺ��ɺͲ������ֱ仯��ԭ����__________________________��ԭ��_______________________��

(3)ֱ�Ӷ�����ȼ�ϵ���������ģ��ҵ��Ӧ�ã�����ԭ����ͼ2��ʾ��
�ٸõ�صĸ�����ӦʽΪ��_______________��
��ijֱ�Ӷ�����ȼ�ϵ��װ�õ�����������Ϊ 50%�������ø�ȼ�ϵ�ص���Ȼ�ͭ��Һ�������� 2.3g �����ѣ��õ�ͭ������Ϊ_______ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ú�﮷�������Ҫ����Ԫ�صĺ�����Li 3.50% Ni 6.55% Ca 6.41% Mg 13.24%���Ʊ�Li2CO3���������Ʊ�Li+��ص���������LiFePO4�����ֹ����������£�
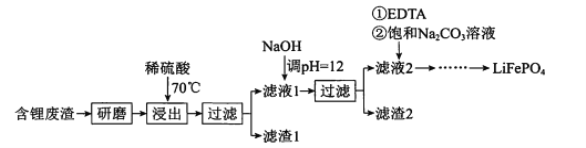
���ϣ�����Һ1����Һ2�в������ߵ�Ũ�ȣ�g/L��

��EDTA�ܺ�ijЩ���۽��������γ��ȶ���ˮ��������
��ijЩ�����ܽ�ȣ�S����
I���Ʊ�Li2CO3��Ʒ
(l)����������Ϊ�ӿ컯ѧ��Ӧ���ʶ���ȡ�Ĵ�ʩ�� ___��
(2)����Һ2���ȼ���EDTA���ټ��뱥��Na2CO3��Һ��90���ַ�Ӧ����� ����Li2CO3��Ʒ�IJ����� ______��
(3)����lkg���3.50%�ķ�����﮵Ľ�����Ϊa��Li+ת��ΪLi2CO3��ת����Ϊb�����Ʒ�к�Li2CO3�������� ____g����Ħ��������Li 7 g.mol-l Li2CO3 74 g.mol-l��
II������Li2CO3��Ʒ
(4)��Li2CO3ת��ΪLiHCO3���ø�Ĥ�����LiHCO3��Һ�Ʊ��ߴ��ȵ�LiOH����ת���õ�ؼ�Li2CO3�����ԭ����ͼ��ʾ�������ĵ缫��Ӧʽ�� _______��
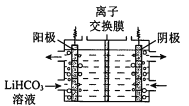
III���Ʊ�LiFePO4
(5)����ؼ�Li2CO3��C��FePO4�����·�Ӧ������LiFePO4��һ�ֿ�ȼ�����壬�÷�Ӧ�Ļ�ѧ����ʽ��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����ͬpH������һԪ����HA��HB��Һ�ֱ��ˮϡ�ͣ���ҺpH���ˮ����仯��������ͼ��ʾ������˵����ȷ����
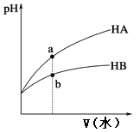
A. HB������ǿ��HA
B. a����Һ�ĵ����Դ���b����Һ
C. ͬŨ�ȵ�NaA��NaB��Һ�У�c(A-)=c(B-)
D. ��ˮϡ�͵�pH��ͬʱ����HA��HB�õ���ˮV(A)С��V(B)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2��һ����Ҫ�������Դ��
��1����֪��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H2=-49.0kJmol-1
CH3OH(g)+H2O(g) ��H2=-49.0kJmol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H3=-41.1kJmol-1
CO2(g)+H2(g) ��H3=-41.1kJmol-1
H2��ԭ CO��Ӧ�ϳɼ״����Ȼ�ѧ����ʽΪ��CO(g)+2H2(g)![]() CH3OH(g) ��H1������H1��___kJmol-1���÷�Ӧ�Է����е�����Ϊ___
CH3OH(g) ��H1������H1��___kJmol-1���÷�Ӧ�Է����е�����Ϊ___
A������ B������ C���κ��¶�������
��2�����º�ѹ�£����ݻ��ɱ���ܱ������м��� 1molCO��2.2mol H2��������ӦCO(g)+2H2(g)![]() CH3OH(g)��ʵ����ƽ��ʱCO��ת�������¶ȡ�ѹǿ�ı仯��ͼ��ʾ����P1__P2���жϵ�������_____��
CH3OH(g)��ʵ����ƽ��ʱCO��ת�������¶ȡ�ѹǿ�ı仯��ͼ��ʾ����P1__P2���жϵ�������_____��
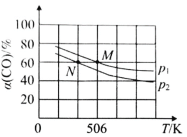
��3������Ӧ CO(g)+2H2(g)![]() CH3OH(g)���¶Ȳ���������㶨Ϊ1���ܱ������з�������Ӧ�����и����ʵ����ʵ�����ʱ��仯�����ʾ��
CH3OH(g)���¶Ȳ���������㶨Ϊ1���ܱ������з�������Ӧ�����и����ʵ����ʵ�����ʱ��仯�����ʾ��
ʱ��/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
�����и�������Ϊ�жϸ÷�Ӧ�ﵽƽ���־����____(����ĸ)��
A��������ѹǿ���ֲ��� B��2v��
C������������Է����������ֲ��� D�����������ܶȱ��ֲ���
������ʼѹǿΪP0 kPa�����ڸ��¶��·�Ӧ��ƽ�ⳣ��Kp=___(kPa)-2����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
�۷�Ӧ�������õ�λʱ���ڷ�ѹ�ı仯��ʾ����10min��H2�ķ�Ӧ����v(H2)=___kPamin-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������;�㷺��ij��������Ҫ�ɷ���NiFe2O4������������NiO��FeO��CaO��SiO2�ȣ������ǴӸÿ����л���NiSO4�Ĺ���·�ߣ�
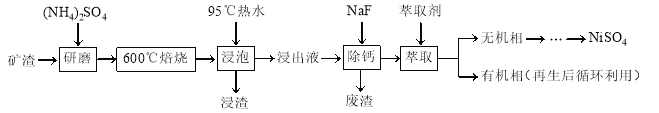
��֪��(NH4)2SO4��350�����ϻ�ֽ�����NH3��H2SO4��NiFe2O4�ڱ��չ���������NiSO4��Fe2(SO4)3������Sn��λ�ڵ������ڵڢ�A�塣
��1������ǰ��������(NH4)2SO4�����ĥ�������ĥ��Ŀ����______________��
��2�������ݡ�������Fe2(SO4)3����FeO(OH)�����ӷ���ʽΪ______________�����������ijɷֳ�Fe2O3��FeO(OH)�����______________���ѧʽ����
��3��Ϊ��֤��Ʒ���ȣ�Ҫ��⡰����Һ������������ȡһ������Ľ���Һ���������ữ����SnCl2��Fe3+��ԭΪFe2+������SnCl2�����ʵ���������Fe3+���ʵ�����________������ȥ������SnCl2����������K2Cr2O7����Һ�ζ���Һ�е�Fe2+����ԭ����ΪCr3+���ζ�ʱ��Ӧ�����ӷ���ʽΪ______________��
��4��������Һ����c(Ca2+) = 1.0��10��3mol��L��1���������ʴﵽ99%ʱ����Һ��c(F��) = ________ mol��L��1��[��֪Ksp (CaF2)=4.0��10��11]
��5���������У���ȡ������Һ���������V0/VA������Һ��Ni2+��Fe2+����ȡ��Ӱ����ͼ��ʾ��V0/VA�����ȡֵ��________��
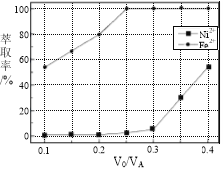
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ�������
A.���ص������Ϸ���ʧ���ӵ�������Ӧ
B.�ö��Ե缫���Na2SO4��Һ��������������������ʵ���֮��Ϊ1��2
C.�ö��Ե缫��ⱥ��NaCl��Һ������1 mol���ӷ���ת�ƣ�������1 mol NaOH
D.����Һ������Һ������Һ������Һ��pH������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��X(g)��2Y(g)![]() 3Z(g)�� H����a kJ��mol��1(a��0)������˵���������( )
3Z(g)�� H����a kJ��mol��1(a��0)������˵���������( )
A.0.1 mol X��0.2 mol Y��ַ�Ӧ����Z���ų�����һ��С��0.1 a kJ
B.Y����ʼŨ�Ȳ���Ϊ�㣬ƽ��Ũ��Ҳ����Ϊ��
C.�������������������£��ı䷴Ӧ�¶ȣ�ƽ��һ���ᷢ���ƶ�
D.����Ӧ�ﵽƽ��״̬ʱ��һ������3v(Y)��=2v(Z)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com