
【题目】高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
⑴工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。请结合相关信息,补充完整提纯硝酸锶的下列实验步骤:
①取含杂质的硝酸锶样品,_____,搅拌。
②_____。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH=7~8,过滤。
④将滤液用硝酸调节pH=2~3,_____,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
⑵Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数_________(写出计算过程)。
【答案】向其中加入浓HNO3 过滤,并用浓HNO3洗涤滤渣 蒸发浓缩,冷却结晶 m(样品)=5.20 g+5.08 g=10.28g,n(SrO)=![]() =0.05 mol;n[Sr(NO3)2]×212 g·mol-1+ n[Sr(NO2)2]×180 g·mol-1=10.28 g,n[Sr(NO3)2]+ n[Sr(NO2)2] =0.05mol,解得n([Sr(NO3)2]=0.04mol,n[Sr(NO2)2]=0.01mol,ω[Sr(NO2)2]=
=0.05 mol;n[Sr(NO3)2]×212 g·mol-1+ n[Sr(NO2)2]×180 g·mol-1=10.28 g,n[Sr(NO3)2]+ n[Sr(NO2)2] =0.05mol,解得n([Sr(NO3)2]=0.04mol,n[Sr(NO2)2]=0.01mol,ω[Sr(NO2)2]= ![]() ×100%=82.49%
×100%=82.49%
【解析】
(1)利用信息“硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸”,可确定提纯硝酸锶的步骤:
①将样品加入浓HNO3中,搅拌;
②过滤,并用浓HNO3洗涤滤渣,取滤渣(含有硝酸锶、硝酸钡);
④将滤渣中的硝酸钡沉淀分离除去;
⑤取滤液(含硝酸锶),再通过蒸发浓缩,冷却结晶,过滤,洗涤便可得到较纯的硝酸锶晶体;
(2)根据质量守恒定律计算样品质量,根据Sr原子守恒、Sr(NO2)2的Sr(NO3)2的总质量列方程计算各自物质的量,进而计算样品中Sr(NO3)2的质量分数。
(1)利用信息“硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸”,可确定提纯硝酸锶的步骤:
①将样品加入浓HNO3中,搅拌;
②过滤,并用浓HNO3洗涤滤渣,取滤渣(含有硝酸锶、硝酸钡);
④将滤渣中的硝酸钡沉淀分离除去;
⑤取滤液(含硝酸锶),再通过蒸发浓缩,冷却结晶,过滤,洗涤便可得到较纯的硝酸锶晶体,
故答案为:①向其中加入浓HNO3;②过滤,并用浓HNO3洗涤滤渣;④蒸发浓缩,冷却结晶;
(2)m(样品)=5.20 g+5.08 g=10.28g,n(SrO)=![]() =0.05 mol;n[Sr(NO3)2]×212 g·mol-1+ n[Sr(NO2)2]×180 g·mol-1=10.28 g,n[Sr(NO3)2]+ n[Sr(NO2)2] =0.05mol,解得n([Sr(NO3)2]=0.04mol,n[Sr(NO2)2]=0.01mol,ω[Sr(NO2)2]=
=0.05 mol;n[Sr(NO3)2]×212 g·mol-1+ n[Sr(NO2)2]×180 g·mol-1=10.28 g,n[Sr(NO3)2]+ n[Sr(NO2)2] =0.05mol,解得n([Sr(NO3)2]=0.04mol,n[Sr(NO2)2]=0.01mol,ω[Sr(NO2)2]= ![]() ×100%=82.49%;
×100%=82.49%;
答:该样品中Sr(NO3)2的质量分数为82.49%。


科目:高中化学 来源: 题型:
【题目】25℃时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随加水体积变化的曲线如图所示。下列说法正确的是
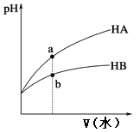
A. HB的酸性强于HA
B. a点溶液的导电性大于b点溶液
C. 同浓度的NaA与NaB溶液中,c(A-)=c(B-)
D. 加水稀释到pH相同时,酸HA、HB用到的水V(A)小于V(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式如下:①![]() ;②
;②![]() ;③
;③![]() ;④
;④![]() 则下列有关比较中正确的是
则下列有关比较中正确的是![]()
A.第一电离能:③>②>④>①
B.原子半径:①>②>④>③
C.电负性:③>①>②>④
D.最高正化合价:③>①>②>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ·mol-1,CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ·mol-1。现有H2与CH4的混合气体112L(标准状况下),使其完全燃烧生成CO2(g)和H2O(l),若实验测得反应放热3845.8kJ,则原混合气体中H2与CH4的物质的量之比是( )
A.1:1B.1:3C.1:4D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过血液中的钙离子的检测能够帮助判断多种疾病。某研究小组为测定血液样品中Ca2+的含量(100mL血液中含Ca2+的质量),实验步骤如下:
①准确量取5.00mL血液样品,处理后配制成50.00mL溶液;
②准确量取溶液10.00mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00mL0.0010mol·L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
⑤用0.0020mol·L-1(NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液20.00mL。
(1)已知室温下CaC2O4的Ksp=2.0×10-9,欲使步骤②中c(Ca2+)≤1.0×10-5mol·L-1,应保持溶液中c(C2O42-)≥_____mol·L-1。
(2)步骤⑤中有Mn2+生成,发生反应的离子方程式为_____。
(3)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将____(填“偏高”、“偏低”或“不变”)。
(4)计算血样中Ca2+的含量_____(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) H=﹣a kJ·molˉ1(a>0)。下列说法错误的是( )
3Z(g) H=﹣a kJ·molˉ1(a>0)。下列说法错误的是( )
A.0.1 mol X和0.2 mol Y充分反应生成Z,放出能量一定小于0.1 a kJ
B.Y的起始浓度不能为零,平衡浓度也不能为零
C.在其他条件不变的情况下,改变反应温度,平衡一定会发生移动
D.当反应达到平衡状态时,一定存在3v(Y)正=2v(Z)逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生反应N2+3H2![]() 2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
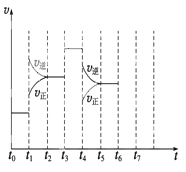
(1)处于平衡状态的时间段是 (填选项)。
A.t0~t1
B.t1~t2
C.t2~t3
D.t3~t4
E.t4~t5
F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是_____(填选项)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.加催化剂
F.充入氮气
t1时刻 ;t3时刻 ;t4时刻 。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 (填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸钠甲醛(xNaHSO2yHCHOzH2O)俗称吊白块,在印染、医药以及原子能工业中有广泛应用。它的组成可通过下列实验测定:①准确称取1.5400g样品,完全溶于水配成100mL溶液。②取25.00mL所配溶液经AHMT分光光度法测得甲醛物质的量浓度为0.10mol×L-1。③另取25.00mL所配溶液,加入过量碘完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.5825g。次硫酸氢钠和碘反应的方程式如下:xNaHSO2yHCHOzH2O+I2→NaHSO4+HI+HCHO+H2O(未配平)
(1)生成0.5825g白色固体时,需要消耗碘的质量为_____。
(2)若向吊白块溶液中加入氢氧化钠,甲醛会发生自身氧化还原反应,生成两种含氧有机物,写出该反应的离子方程式_____。
(3)通过计算确定次硫酸氢钠甲醛的组成______(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2molA和2molB两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),2min末反应达到平衡状态, 生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态, 生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于_____________
(2)A的转化率为_______________
(3)生成D的反应速率为_____________
(4)如果增大反应体系的压强,则平衡体系中C的质量分数 _________(填增大、减小或不变)
(5)在此温度下,该化学反应的平衡常数k=__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com