
【题目】在一密闭容器中发生反应N2+3H2![]() 2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
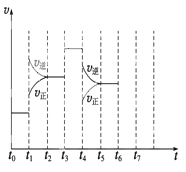
(1)处于平衡状态的时间段是 (填选项)。
A.t0~t1
B.t1~t2
C.t2~t3
D.t3~t4
E.t4~t5
F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是_____(填选项)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.加催化剂
F.充入氮气
t1时刻 ;t3时刻 ;t4时刻 。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 (填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
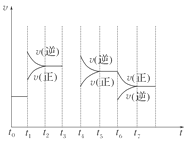
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 。
【答案】(1)ACDF
(2)C E B
(3)A
(4)
(5)5 ∶6
【解析】
(1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v(正)、v(逆)相等,反应处于平衡状态。
(2)t1时,v(正)、v(逆)同时增大,且v(逆)增大得更快,平衡向逆反应方向移动,所以t1时改变的条件是升温。t3时,v(正)、v(逆)同时增大且增大量相同,平衡不移动,所以t3时改变的条件是加催化剂。t4时,v(正)、v(逆)同时减小,但平衡向逆反应方向移动,所以t4时改变的条件是减小压强。
(3)根据图示知,t1~t2、t4~t5时间段内平衡均向逆反应方向移动,NH3的含量均比t0~t1时间段的低,所以t0~t1时间段内NH3的百分含量最大。
(4)t6时刻分离出NH3,v(逆)马上减小,而v(正)逐渐减小,在t7时刻二者相等,反应重新达平衡,据此可画出反应速率的变化曲线。
(5)设反应前加入a mol N2,b mol H2,达平衡时生成2x mol NH3,则反应后气体总的物质的量=(a+b-2x)mol,=0.2,解得:a+b=12x,故反应后与反应前的混合气体体积之比===。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】水溶液是中学化学的重点研究对象。
(1)水是极弱的电解质,也是最重要的溶剂。常温下某电解质溶解在水中后,溶液中的c(H+)=10-9 mol·L-1,则该电解质可能是____(填序号)。
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(2)已知次氯酸是比碳酸还弱的酸,要使新制稀氯水中的c(HClO)增大,可以采取的措施为(回答两种)____,_____。
(3)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,结果溶液均呈中性。
①浓度为1.0×10-3mol·L-1的氨水bL;
②c(OH-)=1.0×10-3mol·L-1的氨水cL;
③c(OH-)=1.0×10-3mol·L-1的氢氧化钡溶液dL
则a、b、c、d之间的大小关系是___。
(4)已知:H2A=H++HA-,HA-![]() H++A2-。常温下,0.1mol·L-1的NaHA溶液其pH=2,则0.1mol·L-1的H2A溶液中氢离子浓度的大小范围是___<c(H+)<___;NaHA溶液中各种离子浓度大小关系为____。
H++A2-。常温下,0.1mol·L-1的NaHA溶液其pH=2,则0.1mol·L-1的H2A溶液中氢离子浓度的大小范围是___<c(H+)<___;NaHA溶液中各种离子浓度大小关系为____。
(5)已知:Ksp(AgCl)=1.8×10-10,向50 mL0.018mol·L-1的AgNO3溶液中加入相同体积0.020mol·L-1的盐酸,所得混合溶液的pH=___,c(Ag+)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肯定属于同族元素且性质相似的是
A. A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
B. 结构示意图:A为 ![]() ,B为
,B为![]()
C. A原子基态时2p轨道有1个未成对电子,B原子基态时3p轨道也有1个未成对电子
D. 原子核外电子排布式:A为1s22s2,B为1s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
⑴工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。请结合相关信息,补充完整提纯硝酸锶的下列实验步骤:
①取含杂质的硝酸锶样品,_____,搅拌。
②_____。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH=7~8,过滤。
④将滤液用硝酸调节pH=2~3,_____,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
⑵Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数_________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸锶[Sr(NO3)2]常作为制备焰火、信号弹的原料。实验室以生产碳酸锶工厂的废渣(含SrCO338.40%,SrO12.62%,CaCO338.27%,BaCO32.54%,MgCO31.88%,其它不溶于硝酸的杂质6.29%)为原料制备硝酸锶粗品的部分实验过程如下:

表3 两种盐的溶解度(g/100g水)

(1)废渣粉碎的目的是_____。
(2)由浸取后得到的混合物制备硝酸锶粗品的实验步骤依次为:①__;②__;③__;④洗涤,干燥。
(3)制得的硝酸锶粗品中含有少量Ca(NO3)2、Ba(NO3)2等杂质。实验室测定硝酸锶纯度的实验步骤如下:准确称取一定质量的硝酸锶样品,加入1∶1无水乙醇与乙醚的混合液萃取硝酸钙,用水溶解分离硝酸钙后的样品,于250mL容量瓶中定容得样品溶液。准确移取25.00mL样品溶液,调节pH为7,加入指示剂,加热至微沸,立即用碳酸钠标准溶液滴定至终点。另取样品溶液用比浊法测得硝酸钡的含量。滴定过程中反应的离子方程式为:Sr2++CO32-=SrCO3↓, Ba2++CO32-=BaCO3↓。
①滴定选用的指示剂为_____,滴定终点观察到的现象为_____。
②若滴定前样品中Ca(NO3)2没有除尽,所测定的硝酸锶纯度将会_____(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面均是正丁烷与氧气反应的热化学方程式(25℃,101 kPa):
①C4H10(g)+![]() O2(g)=4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
O2(g)=4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
②C4H10(g)+![]() O2(g)=4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
O2(g)=4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
③C4H10(g)+![]() O2(g)=4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
O2(g)=4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
④C4H10(g)+![]() O2(g)=4CO(g)+5H2O(g) ΔH=-1 526 kJ·mol-1
O2(g)=4CO(g)+5H2O(g) ΔH=-1 526 kJ·mol-1
由此判断,正丁烷的燃烧热是 ( )
A.ΔH=-1 746kJ·mol-1B.ΔH=-2 658 kJ·mol-1
C.ΔH=-2 878 kJ·mol-1D.ΔH=-1 526 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)2SO3(g) ΔH<0某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
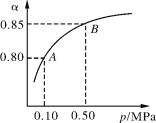
(1)将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于 ______________________。(不需要写表达式)
(2)平衡状态由A变到B时,平衡常数K(A)___________ K(B)(填“>”、“<”或“=”)。
(3)此反应在恒温密闭的装置中进行,能充分说明此反应已达到平衡的标志是______。
A.接触室中气体的平均相对分子质量不再改变
B.接触室中SO2、O2、SO3的浓度相同
C.接触室中SO2、O2、SO3的物质的量之比为2∶1∶2
D.接触室中压强不随时间变化而变化
(II)已知工业制氢气的反应为CO(g)+H2O(g) CO2(g)+H2(g),反应过程中能量变化如下图所示。在500 ℃时的平衡常数K=9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
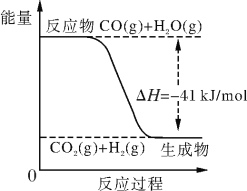
(4)增加H2O(g)的浓度,CO的转化率将________(填“增大”、“减小”或“不变”)。
(5)平衡常数的表达式K=_______。400 ℃时平衡常数K________9(填“>”、“<” 或“=”)。
(6)已知2H2(g)+O2(g) 2H2O (g) ΔH=-484 kJ/mol。结合上图写出CO完全燃烧生成CO2的热化学方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物。请回答下列问题:
(1)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Mn属于___区。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti2+中电子占据的最高能层符号为___,该能层具有的原子轨道数为___,BH4-的空间构型是___。
(3)在Cu的催化作用下,乙醇可被空气中氧气氧化为乙醛,乙醛分子中碳原子的杂化方式是___,乙醛分子中HCO的键角___乙醇分子中H-C-O的键角(填“大于”、“等于”或“小于”)。
(4)电镀厂排放的废水中常含有剧毒的CN-,可在TiO2的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为___。
②与CN-互为等电子体微粒的化学式为___(写出一种即可)。
(5)单质铁有δ、γ、α三种同素异形体,三种晶胞中Fe原子的配位数之比为___,δ、γ、α三种晶胞的边长之比为___。
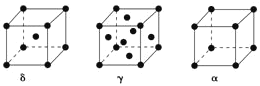
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回收利用硫和氮的氧化物是环境保护的重要举措。
(1)已知:2NO(g ) + O2(g)![]() 2NO2(g),正反应的活化能为c kJmolˉ1。该反应历程为:
2NO2(g),正反应的活化能为c kJmolˉ1。该反应历程为:
第一步:2NO(g ) ![]() N2O2(g) △H1 =-a kJmolˉ1 (快反应)
N2O2(g) △H1 =-a kJmolˉ1 (快反应)
第二步:N2O2(g ) + O2(g)![]() 2NO2(g) △H2 =-b kJmolˉ1 (慢反应)
2NO2(g) △H2 =-b kJmolˉ1 (慢反应)
①下列对上述反应过程表述正确的是__________(填标号)。
A.NO比N2O2稳定
B.该化学反应的速率主要由第二步决定
C.N2O2为该反应的中间产物
D.在一定条件下N2O2的浓度为0时反应达到平衡
②该反应逆反应的活化能为_______________。
(2)通过下列反应可从燃煤烟气中回收硫。2CO(g) + 2SO2(g)![]() 2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:
2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:
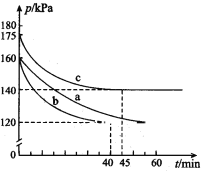
①与实验a相比,实验b改变的实验条件可能是______________________。
②实验b中的平衡转化率a(SO2)=_________。
(3)用NH3消除NO污染的反应原理为: 4NH3 + 6NO![]() 5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:
5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:

①曲线c对应NH3与NO 的物质的量之比是_______________。
②曲线a中 NO的起始浓度为4×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____________ mg/(m3s)。
(4)双碱法除去SO2是指:用 NaOH 吸收SO2,并用CaO使 NaOH再生。NaOH溶液 ![]() Na2SO3溶液
Na2SO3溶液
①用化学方程式表示NaOH 再生的原理____________________________________ 。
②25℃ 时,将一定量的SO2通入到NaOH溶液中,两者完全反应,得到含Na2SO3、 NaHSO3的混合溶液,且溶液恰好呈中性,则该混合溶液中各离子浓度由大到小的顺序为_____________(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com