
【题目】水溶液是中学化学的重点研究对象。
(1)水是极弱的电解质,也是最重要的溶剂。常温下某电解质溶解在水中后,溶液中的c(H+)=10-9 mol·L-1,则该电解质可能是____(填序号)。
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(2)已知次氯酸是比碳酸还弱的酸,要使新制稀氯水中的c(HClO)增大,可以采取的措施为(回答两种)____,_____。
(3)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,结果溶液均呈中性。
①浓度为1.0×10-3mol·L-1的氨水bL;
②c(OH-)=1.0×10-3mol·L-1的氨水cL;
③c(OH-)=1.0×10-3mol·L-1的氢氧化钡溶液dL
则a、b、c、d之间的大小关系是___。
(4)已知:H2A=H++HA-,HA-![]() H++A2-。常温下,0.1mol·L-1的NaHA溶液其pH=2,则0.1mol·L-1的H2A溶液中氢离子浓度的大小范围是___<c(H+)<___;NaHA溶液中各种离子浓度大小关系为____。
H++A2-。常温下,0.1mol·L-1的NaHA溶液其pH=2,则0.1mol·L-1的H2A溶液中氢离子浓度的大小范围是___<c(H+)<___;NaHA溶液中各种离子浓度大小关系为____。
(5)已知:Ksp(AgCl)=1.8×10-10,向50 mL0.018mol·L-1的AgNO3溶液中加入相同体积0.020mol·L-1的盐酸,所得混合溶液的pH=___,c(Ag+)=____。
【答案】CD 再通入氯气 加入碳酸盐或加入次氯酸钠 b>a=d>c 0.1mol·L-1 0.11mol·L-1 c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) 2 1.8×10-7 mol·L-1
【解析】
(1)常温下,纯水中c(H+)=10-7molL-1,加入某物质后,溶液中c(H+)=10-9molL-1,说明溶液呈碱性,则加入的物质的水溶液呈碱性;
(2)氯水中存在的平衡是Cl2+H2OH++Cl-+HClO、HClOH++ClO-,要使c(HClO)增大,加入某些物质使Cl2+H2OH++Cl-+HClO的平衡向正反应方向移动或使HClOH++ClO-的平衡向逆反应方向移动;
(3)一水合氨为弱电解质,不能完全电离,pH相同时,氨水浓度最大;
(4)H2A=H++HA-,HA-H++A2-可知,第一步完全电离,第二步不完全电离,结合0.1molL-1NaHA溶液的pH=2确定0.1molL-1的H2A溶液中氢离子浓度的大小范围,0.1molL-1NaHA溶液的pH=2,则HA-的电离大于其水解,再结合水解、电离的相关知识来解答;
(5)根据混合溶液中氯离子的浓度结合溶度积常数计算银离子浓度,根据氢离子浓度计算溶液的pH。
(1)常温下,纯水中c(H+)=10-7molL-1,加入某物质后,溶液中c(H+)=10-9molL-1,说明溶液呈碱性,则加入的物质是碱或强碱弱酸盐,故选CD;
故答案为 CD;
(2)氯水中存在的平衡是Cl2+H2OH++Cl-+HClO、HClOH++ClO-,要使c(HClO)增大,加入某些物质使Cl2+H2OH++Cl-+HClO的平衡向正反应方向移动或使HClOH++ClO-的平衡向逆反应方向移动,所以可以通入氯气或加入碳酸盐或加入次氯酸盐;
故答案为:再通入氯气、加入碳酸盐或加入次氯酸钠;
(3)一水合氨为弱电解质,不能完全电离,与盐酸反应至中性时,氨水应稍过量,则b>a,c(OH-)=1.0×10-3molL-1的氨水,一水合氨浓度远大于1.0×10-3mol.L-l的氨水,反应至中性时,a>c,氢氧化钡为强碱,与盐酸完全中和时,a=d,则b>a=d>c;
故答案为:b>a=d>c;
(4)H2A=H++HA-,HA-H++A2-可知,第一步完全电离,第二步不完全电离,0.1molL-1的H2A溶液中H2A第一步电离出氢离子浓度是0.1mol/L,0.1molL-1的NaHA溶液其pH=2,说明HA-电离比水解多出0.01mol/L,HA-的电离较微弱,所以电离出氢离子浓度小于0.01mol/L,则0.1molL-1的H2A溶液中氢离子浓度的大小范围是0.1mol/L<c(H+)<0.11mol/L,NaHA溶液中HA-的电离大于其水解,则离子浓度的关系是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);
故答案为 0.11mol·L-1; c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);
(5)盐酸和硝酸银反应的物质的量之比是1:1,n(AgNO3)=0.05L×0.018molL-1=9×10-4 mol,n(HCl)=0.05L×0.020molL-1=1×10-3 mol,n(AgNO3)<n(HCl),所以盐酸剩余,混合溶液中C(Cl-)=c(HCl)=![]() =10-3 mol/L,c(Ag+)=
=10-3 mol/L,c(Ag+)=![]()
![]() =1.8×10-7 mol/L,c(H+)=0.01mol/L,pH=2;
=1.8×10-7 mol/L,c(H+)=0.01mol/L,pH=2;
故答案为 2;1.8×10-7 mol·L-1。


科目:高中化学 来源: 题型:
【题目】近几年,节能减排、提高原料利用率来提高经济效益成为人们关注的焦点。某化工厂利用甲烷与氯气反应得到的副产品来制取盐酸实现了变废为宝的梦想,其生产原理可在实验室中模拟如图,请根据要求填空:

(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③__________。
(2)设![]() =x,若理论上欲获得最多的氯化氢,则x值应_________。
=x,若理论上欲获得最多的氯化氢,则x值应_________。
(3)在C装置中,经过一段时间的强光照射后,发现硬质玻璃管内壁附着有油珠,生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应化学方程式为2CHCl3+O2![]() 2COCl2+2HCl,上述反应__________ (填选项符号,下同)。
2COCl2+2HCl,上述反应__________ (填选项符号,下同)。
A.属于取代反应 B.不属于取代反应
为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是____________。
A.氢氧化钠溶液 B.硝酸银溶液
C.稀盐酸 D.水
E.湿润的蓝色石蕊试纸 F.湿润的无色酚酞试纸
(4)D装置的石棉中均匀混有KI粉末,其作用是___________。
(5)E装置的作用是____________ (填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为_____________;该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为_____ (填编号)。
①CH4 ②CH3Cl ③CH2Cl2 ④CHCl3 ⑤CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时c(CO2) 随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时c(CO2) 随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
A.该反应的ΔH>0、ΔS<0
B.体系的总压强p:p(Ⅰ)>p(Ⅲ)
C.平衡常数:K(Ⅰ)>K(Ⅱ)
D.T1K时,Ⅳ点所处的状态中v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随加水体积变化的曲线如图所示。下列说法正确的是
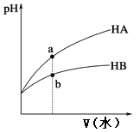
A. HB的酸性强于HA
B. a点溶液的导电性大于b点溶液
C. 同浓度的NaA与NaB溶液中,c(A-)=c(B-)
D. 加水稀释到pH相同时,酸HA、HB用到的水V(A)小于V(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.含有大量NO3-的溶液:H+、K+、Cl-、Fe2+
B.中性溶液:Fe3+、Al3+、NO3-、SO42-
C.![]() =1×10-12的溶液:K+、AlO2-、CO32-、Na+
=1×10-12的溶液:K+、AlO2-、CO32-、Na+
D.由水电离出的c(H+)=10-12mol/L的溶液:Na+、K+、CO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
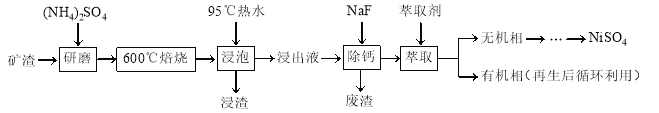
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是______________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为______________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有______________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的________倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为______________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________ mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
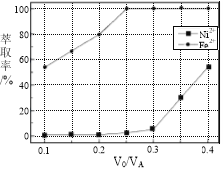
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2013·北江中学月考)将下列物质分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水面呈现如图所示状态。加入的物质不可能是(不考虑加入物质引起的溶液体积的变化)
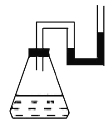
A.固体NaOH B.浓H2SO4
C.Ba(OH)2·8H2O与NH4Cl糊状物 D.CaO固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式如下:①![]() ;②
;②![]() ;③
;③![]() ;④
;④![]() 则下列有关比较中正确的是
则下列有关比较中正确的是![]()
A.第一电离能:③>②>④>①
B.原子半径:①>②>④>③
C.电负性:③>①>②>④
D.最高正化合价:③>①>②>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生反应N2+3H2![]() 2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
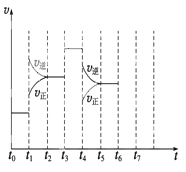
(1)处于平衡状态的时间段是 (填选项)。
A.t0~t1
B.t1~t2
C.t2~t3
D.t3~t4
E.t4~t5
F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是_____(填选项)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.加催化剂
F.充入氮气
t1时刻 ;t3时刻 ;t4时刻 。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 (填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com