
【题目】取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )

A. b电极是阴极B. a电极与电源的正极相连
C. 电解过程中水是氧化剂D. b电极附近溶液的pH变小
【答案】D
【解析】
惰性电极电解饱和食盐水,总反应为2Cl-+2H2O![]() H2↑+Cl2↑+2OH-,阴极:2H++2e-= H2↑,阳极:2Cl—2e-= Cl2↑。根据题意a电极与试纸接触处出现一个双色同心圆,内圆为白色,外圈呈浅红色,说明a电极先生成氯气,漂白pH试纸,后OH-放电生成氧气,氢氧根浓度降低,酸性增强,故pH试纸外圈呈红色。故a极为阳极,与电源正极相连,b为阴极与电源负极相连,据此分析解答。
H2↑+Cl2↑+2OH-,阴极:2H++2e-= H2↑,阳极:2Cl—2e-= Cl2↑。根据题意a电极与试纸接触处出现一个双色同心圆,内圆为白色,外圈呈浅红色,说明a电极先生成氯气,漂白pH试纸,后OH-放电生成氧气,氢氧根浓度降低,酸性增强,故pH试纸外圈呈红色。故a极为阳极,与电源正极相连,b为阴极与电源负极相连,据此分析解答。
A项,由分析可知,b电极为阴极,故A项正确;
B项,a电极为阳极与电源正极相连,故B项正确;
C项,电解过程中,水分子中氢元素由+1价降为0价,被还原,为氧化剂,故C项正确;
D项,b为阴极与电源负极相连,电极式为2H++2e-= H2↑,氢离子浓度降低,氢氧根浓度升高,故溶液pH变大,故D项错误。
答案选D。


科目:高中化学 来源: 题型:
【题目】有机玻璃(聚甲基丙烯酸甲酯)具有透光率高、自重轻、安全性能高等优点,目前它广泛用于制作仪器仪表零件、照明灯罩、光学镜片、透明屋顶、电话亭、广告灯箱、标志牌等。
下图是以2—甲基丙烯为原料合成有机玻璃E(聚—2—甲基丙烯酸甲酯)的路线:
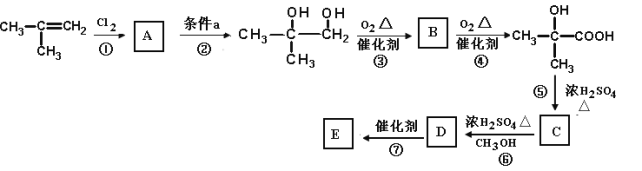
(1)有机化合物 中含有的官能团名称是_____________________________________。
中含有的官能团名称是_____________________________________。
(2)写出B的结构简式:___________________________________
(3)写出反应①的化学方程式____________________________________________________________________
(4)写出反应⑥的化学方程式__________________________________________________________________
(5)在上述① ~ ⑥反应中,属于取代反应的是______________,属于加成反应的是___________,
(6)写出E的结构简式:___________________________
(7)写出有机物 通过缩聚形成高分子聚酯F的结构简式:___________________________
通过缩聚形成高分子聚酯F的结构简式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,1-二环丙基乙烯(![]() )是重要医药中间体,下列关于该化合物的说法错误的是
)是重要医药中间体,下列关于该化合物的说法错误的是
A. 所有碳原子可能在同一平面B. 能使酸性高锰酸钾溶液褪色
C. 二氯代物有9种D. 生成1mol C8H18至少需要3mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理请回答下列问题:
(1)常温下,某纯碱溶液中滴入酚酞,溶液呈红色,则该溶液呈 ______性,原因是________________;用离子方程式表示
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于 ______________;
(3)已知在H2S溶液中存在下列平衡: H2S![]() H++HS-
H++HS-
向H2S溶液中加入NaOH固体时,不考虑温度变化电离平衡向______移动,填“左”或“右”),c(H+)______。(填“增大”、“减小”或“不变”
向H2S溶液中加入NaHS固体时,电离平衡向______移动,填“左”或“右”)c(S2—)______。(填“增大”、“减小”或“不变”)

(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 ______ 填“A”或“B”;设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1______ m2。 (选填“![]() ”、“
”、“![]() ”、“
”、“![]() ”
”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】POC13是重要的化工原料,某兴趣小组准备用三氯化磷、氯气、二氧化硫制备POC13,产物中还有一种遇水强烈水解的物质SOC12。

已知:PC13熔点-93.6℃、沸点76.1℃,遇水强烈水解,易与氧气反应;POC13遇水强烈水解,能溶于PC13.
(1)仪器甲的名称是________________。
(2)已知装置B制备POC13,以上仪器接口连接的顺序为a____d,装置B中发生反应的化学方程式为_________________________。
(3)B中反应温度控制在60~65℃,其原因是__________________________。
(4)用佛尔哈德法测定POC13含量:准确称取20.20g POC13产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;加入10.00mL 3.200mol·L-1AgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;加入指示剂,用0.2000mol·L-1KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00mL KSCN溶液。
(已知:KSP(AgC1)=3.2×10-10,KSP(AgSCN)=2×10-12)
①POC13水解的化学反应方程式为______________________________。
②滴定选用的指示剂是__________(选填字母),滴定终点的现象为__________。
a.FeC12 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
③用硝基苯覆盖沉淀的目的是___________________________________。
④产品中POC13的百分含量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成份CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3和ZnSO4溶液的一种工艺流程如下:
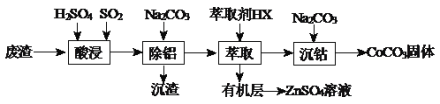
下表是相关金属离子生成氢氧化物沉淀的pH(按金属离子浓度为1.0mol·L-1计算):
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸浸”时发生氧化还原反应的化学方程式________________________。
(2)“除铝”过程中需要调节溶液pH的范围为_________,形成沉渣时发生反应的离子方程式为______________________。
(3)在实验室里,萃取操作用到的玻璃仪器主要有_________________;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______________。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因___________________。
(5)在空气中煅烧CoCO3生成某种钴氧化物和CO2,若充分煅烧一定量CoCO3后测定所得固体质量为2.41g,CO2的体积为0.672L(标准状况),假设固体为纯净物,其化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里可用如下图所示的装置制取氯酸钾、次氯酸钠,并验证氯水的性质。

图中①为氯气发生装置,②的试管中盛有![]() 的
的![]() 溶液,并置于热水浴中,③的试管中盛有
溶液,并置于热水浴中,③的试管中盛有![]() 的
的![]() 溶液,并置于冰水浴中,④的试管中加有紫色石蕊试液,⑤为尾气吸收装置。
溶液,并置于冰水浴中,④的试管中加有紫色石蕊试液,⑤为尾气吸收装置。
(1)制取氯气时,在烧瓶中先加入一定量的二氧化锰固体,再通过_________(填写仪器名称)向烧瓶中加入适量的____________(填写试剂名称)。
(2)为除去氯气中混有的氯化氢气体,可在①和②之间安装盛有__________(选填字母编号)的净化装置。
a.碱石灰 b.饱和食盐水 c.浓硫酸 d.饱和碳酸氢钠溶液
(3)本实验制取次氯酸钠的离子方程式是____________________。
(4)比较制取氯酸钾和次氯酸钠的条件,可以初步得到的结论是__。
(5)反应完毕经冷却后,②的试管中有大量晶体析出,图中符合该晶体溶解度随温度变化规律的曲线是___________(选填字母);从②的试管中分离该晶体的操作是___________(填写实验操作名称)。

(6)实验中可观察到④的试管中溶液颜色会发生变化:最初溶液由紫色变为_________,随后溶液逐渐变为无色,是因为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各式表示水解反应方程式的是( )
A.HCO3-+H2O![]() H3O++CO32-B.HS-+H2O
H3O++CO32-B.HS-+H2O![]() H2S+OH-
H2S+OH-
C.Cu2++H2O![]() Cu(OH)2↓+2H+D.HCO3-+OH-
Cu(OH)2↓+2H+D.HCO3-+OH-![]() H2O+CO32-
H2O+CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com