
【题目】实验室里可用如下图所示的装置制取氯酸钾、次氯酸钠,并验证氯水的性质。

图中①为氯气发生装置,②的试管中盛有![]() 的
的![]() 溶液,并置于热水浴中,③的试管中盛有
溶液,并置于热水浴中,③的试管中盛有![]() 的
的![]() 溶液,并置于冰水浴中,④的试管中加有紫色石蕊试液,⑤为尾气吸收装置。
溶液,并置于冰水浴中,④的试管中加有紫色石蕊试液,⑤为尾气吸收装置。
(1)制取氯气时,在烧瓶中先加入一定量的二氧化锰固体,再通过_________(填写仪器名称)向烧瓶中加入适量的____________(填写试剂名称)。
(2)为除去氯气中混有的氯化氢气体,可在①和②之间安装盛有__________(选填字母编号)的净化装置。
a.碱石灰 b.饱和食盐水 c.浓硫酸 d.饱和碳酸氢钠溶液
(3)本实验制取次氯酸钠的离子方程式是____________________。
(4)比较制取氯酸钾和次氯酸钠的条件,可以初步得到的结论是__。
(5)反应完毕经冷却后,②的试管中有大量晶体析出,图中符合该晶体溶解度随温度变化规律的曲线是___________(选填字母);从②的试管中分离该晶体的操作是___________(填写实验操作名称)。

(6)实验中可观察到④的试管中溶液颜色会发生变化:最初溶液由紫色变为_________,随后溶液逐渐变为无色,是因为___________________。
【答案】分液漏斗 浓盐酸 b ![]() 反应物的温度和浓度影响氯气发生歧化产物的类型 M 过滤 红色 氯气与水反应生成次氯酸将石蕊氧化为无色
反应物的温度和浓度影响氯气发生歧化产物的类型 M 过滤 红色 氯气与水反应生成次氯酸将石蕊氧化为无色
【解析】
(1)二氧化锰与浓盐酸加热制取氯气,浓盐酸盛放在分液漏斗中;
(2)饱和食盐水能溶解氯化氢气体并减小氯气的溶解度;
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
(4)温度与浓度不同,影响发生的氧化还原反应;
(5)冷却后②的试管中有大量晶体析出,说明溶质的溶解度随温度升高而增大;从②的试管中分离该晶体,属于固液分离;
(6)氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性。
(1)二氧化锰与浓盐酸加热制取氯气,浓盐酸盛放在分液漏斗中,所以制取氯气时,在烧瓶中先加入一定量的二氧化锰固体,再通过分液漏斗向烧瓶中加入适量的浓盐酸;
(2)饱和食盐水能溶解氯化氢气体并减小氯气的溶解度,为除去氯气中混有的氯化氢气体,可在①和②之间安装盛有饱和食盐水的净化装置,选b;
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的离子方程式是![]() ;
;
(4)制取氯酸钾和次氯酸钠的条件有两个不同点:①制取温度不同;②制取时碱的浓度也不同,可以初步得到的结论是反应物的温度和浓度影响氯气发生歧化产物的类型。
(5)冷却后②的试管中有大量晶体析出,说明溶质的溶解度随温度升高而增大,图中符合该晶体溶解度随温度变化规律的曲线是M;从②的试管中分离该晶体,属于固液分离,方法是过滤;
(6)氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,所以④的试管中溶液颜色会发生变化:最初溶液由紫色变为红色,次氯酸将石蕊氧化为无色随后溶液逐渐变为无色。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )

A. b电极是阴极B. a电极与电源的正极相连
C. 电解过程中水是氧化剂D. b电极附近溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,同体积的氨气(![]() )和硫化氢气体(
)和硫化氢气体(![]() )的质量比为_________;同质量的氨和硫化氢气体的体积比为___________;若二者氢原子数相等,则它们的体积比为___________。(均为前者比后者)
)的质量比为_________;同质量的氨和硫化氢气体的体积比为___________;若二者氢原子数相等,则它们的体积比为___________。(均为前者比后者)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标出下列氧化还原反应中电子转移的方向和数目____________
![]()
该反应的还原产物是______________;____________元素被氧化;若反应有![]() 电子发生转移,则被还原的氧化剂是_________mol。
电子发生转移,则被还原的氧化剂是_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用一种微生物将废水中的有机物(如淀粉)和废气NO的化学能直接转化为电能,下列说法中一定正确的是

A. 质子透过阳离子交换膜由右向左移动
B. 电子流动方向为N→Y→X→M
C. M电极反应式:(C6H10O5)n+7nH2O-24ne-===6nCO2↑+24nH+
D. 当M电极微生物将废水中16.2 g淀粉转化掉时,N电极产生134.4 L N2(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曾在南充求学和工作过的青年学者孙旭平及其领衔团队,近日成功利用Mo2N纳米催化剂在0.1mol·L1盐酸溶液中进行电催化固氮,装置如图所示,在一定电压下具有较高的产氨速率。下列判断错误的是

A. Mo2N/GCE电极为阴极
B. 溶液中H+通过隔膜向MoN/GCE电极区迁移
C. Mo2N/GCE电极区反应式为N2+6H++6e====2NH3
D. 为提高溶液的导电性,可在石墨电极区加入适量的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷能形成众多单质与化合物。回答下列问题:
(1)磷在成键时,能将一个3s电子激发进入3d能级而参加成键,写出该激发态原子的核外电子排布式__ 。
(2)黑磷是一种二维材料,其中一层的结构如图1所示。
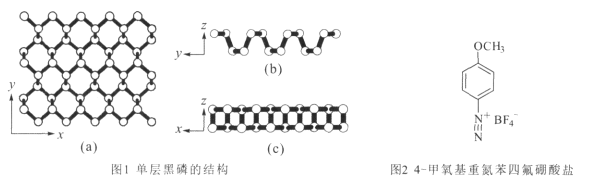
①黑磷中P原子的杂化方式为 _________ 。每一层内P形成六元环彼此相接,平均每个空间六元环中含有的磷原子是 ____个。
②用4-甲氧基重氮苯四氟硼酸盐(如图2)处理黑磷纳米材料,可以保护和控制其性质。
该盐的构成元素中C、N、O、F的电负性由大到小顺序为__,1mol该盐阳离子含有的σ键的数目为______ ,该盐阴离子的几何构型是__。
(3)磷钇矿可提取稀土元素钇(Y),某磷钇矿的结构如下:

该磷钇矿的化学式为__,与PO43—互为等电子体的阴离子有__ (写出两种离子的化学式)。已知晶胞参数a= 0.69 nm,c=0.60 nm,阿伏加德罗常数为NA,则该磷钇矿的密度为__g.cm—3(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com