
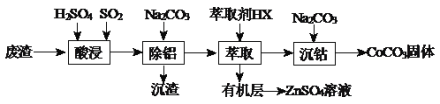
【题目】CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成份CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3和ZnSO4溶液的一种工艺流程如下:
下表是相关金属离子生成氢氧化物沉淀的pH(按金属离子浓度为1.0mol·L-1计算):
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸浸”时发生氧化还原反应的化学方程式________________________。
(2)“除铝”过程中需要调节溶液pH的范围为_________,形成沉渣时发生反应的离子方程式为______________________。
(3)在实验室里,萃取操作用到的玻璃仪器主要有_________________;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______________。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因___________________。
(5)在空气中煅烧CoCO3生成某种钴氧化物和CO2,若充分煅烧一定量CoCO3后测定所得固体质量为2.41g,CO2的体积为0.672L(标准状况),假设固体为纯净物,其化学式为__________。
【答案】Co2O3+SO2+H2SO4=2CoSO4+H2O 5.0≤pH<5.4(或5.0-5.4) 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ 分液漏斗、烧杯 向有机层中加入适量的硫酸溶液充分振荡,静置分离出水层 Na2CO3溶液滴加过快,会导致局部碱性过强而产生Co(OH)2 Co3O4
【解析】
以含钴废渣(主要成份CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3和ZnSO4溶液,根据流程:“酸浸”时金属氧化物与硫酸发生反应而溶解,结合最终产物CoCO3中Co元素价态可得,“酸浸”时SO2的作用是将含钴废渣中+3价的Co还原为+2价;“除铝”时加入Na2CO3,Al3+与CO32-发生双水解反应生成Al(OH)3沉淀除去;加入萃取剂HX(有机物),进一步从有机层得到ZnSO4溶液;“沉钴”时向CoSO4溶液中加入Na2CO3溶液产生CoCO3沉淀。
(1)“酸浸”时加入H2SO4和SO2,由于SO2具有还原性,SO2将钴废渣中+3价的Co还原为+2价,“酸浸”时发生的非氧化还原反应为:CoO+H2SO4=CoSO4+H2O、Al2O3+3H2SO4=Al2(SO4)3+3H2O、ZnO+H2SO4=ZnSO4+H2O,发生的氧化还原反应为Co2O3+SO2+H2SO4=2CoSO4+H2O。
(2)“除铝”过程中Al3+完全沉淀,其它金属阳离子不形成沉淀,根据已知Co2+、Al3+、Zn2+开始沉淀和沉淀完全的pH,“除铝”过程中需要调节溶液pH的范围为5.0~5.4。形成沉渣时加入的是Na2CO3,发生的是Al3+与CO32-的双水解反应,形成沉渣时反应的离子方程式为2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑。
(3)在实验室里,萃取操作用到的玻璃仪器主要有分液漏斗、烧杯;根据萃取反应ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层)可得,由有机层获得ZnSO4溶液,要使平衡逆向移动,所以要向有机层中加入硫酸,然后分液,所以由有机层获取ZnSO4溶液的操作是:向有机层中加入适量的硫酸溶液充分振荡,静置分离出水层。
ZnX2(有机层)+H2SO4(水层)可得,由有机层获得ZnSO4溶液,要使平衡逆向移动,所以要向有机层中加入硫酸,然后分液,所以由有机层获取ZnSO4溶液的操作是:向有机层中加入适量的硫酸溶液充分振荡,静置分离出水层。
(4)“沉钴”时是向CoSO4溶液中加入Na2CO3溶液产生CoCO3沉淀,由于Na2CO3溶液呈碱性,若Na2CO3溶液滴加过快会导致局部碱性过强而产生Co(OH)2沉淀,导致产品CoCO3中混有Co(OH)2。
(5)0.672L(标准状况)CO2的物质的量为0.03mol,根据C元素守恒,n(CoCO3)=n(CO2)=0.03mol;根据Co元素守恒,n(Co)=0.03mol,m(Co)=0.03mol×59g/mol=1.77g,则氧化物中m(O)=2.41g-1.77g=0.64g,所以n(O)=0.04mol,n(Co):n(O)=0.03mol:0.04mol=3:4,故该钴氧化物的化学式为Co3O4。


科目:高中化学 来源: 题型:
【题目】如图:A处通入氯气。关闭B阀时,C处干燥红色布条无变化;打开B阀时,C处干燥红色布条褪色。则D中盛放的试剂不可能的是

A.饱和食盐水B.浓硫酸
C.溴化钠溶液D.氢氧化钙溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的甲烷和氯气混合后,在漫射光的照射下充分反应,生成物中物质的量最大的是 ( )
A. CH3ClB. CH2Cl2C. CCl4D. HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )

A. b电极是阴极B. a电极与电源的正极相连
C. 电解过程中水是氧化剂D. b电极附近溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小王同学准备用CuSO4·5H2O配制490 mL 0.1 mol/L的溶液。
(1)小王同学选用的玻璃仪器有:烧杯,玻璃棒,胶头滴管,___。
(2)玻璃棒在该实验中有重要的用途,分别是___和____;
(3)小王同学通过计算,用托盘天平称取___g CuSO4·5H2O。
(4)物质的量浓度误差(填偏高、偏低、无影响)
A.若容量瓶洗净后未干燥,其中残留少量水,则所配制的溶液浓度将_____;
B.定容时,若眼睛俯视,则所配制的溶液浓度将_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,同体积的氨气(![]() )和硫化氢气体(
)和硫化氢气体(![]() )的质量比为_________;同质量的氨和硫化氢气体的体积比为___________;若二者氢原子数相等,则它们的体积比为___________。(均为前者比后者)
)的质量比为_________;同质量的氨和硫化氢气体的体积比为___________;若二者氢原子数相等,则它们的体积比为___________。(均为前者比后者)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标出下列氧化还原反应中电子转移的方向和数目____________
![]()
该反应的还原产物是______________;____________元素被氧化;若反应有![]() 电子发生转移,则被还原的氧化剂是_________mol。
电子发生转移,则被还原的氧化剂是_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下0.1 mol/L的NaHB(强电解质)溶液中c(H+)>c(OH-),则下列关系一定正确的是( )
A. c(Na+)=c(HB-)+2c(B2-)+c(OH-)
B. c(Na+)=0.1 mol/L≥c(B2-)
C. HB-的水解方程式为HB-+H2O![]() B2-+H3O+
B2-+H3O+
D. 在该盐的溶液中,离子浓度大小顺序为c(Na+)>c(HB-)>c(B2-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com