
【题目】已知某温度下0.1 mol/L的NaHB(强电解质)溶液中c(H+)>c(OH-),则下列关系一定正确的是( )
A. c(Na+)=c(HB-)+2c(B2-)+c(OH-)
B. c(Na+)=0.1 mol/L≥c(B2-)
C. HB-的水解方程式为HB-+H2O![]() B2-+H3O+
B2-+H3O+
D. 在该盐的溶液中,离子浓度大小顺序为c(Na+)>c(HB-)>c(B2-)>c(OH-)>c(H+)
【答案】B
【解析】
在浓度为0.1mol/L的NaHB溶液中c(H+)>(OH-),说明HB-电离程度大于水解程度,溶液呈酸性,结合电荷守恒分析解答。
A.溶液中存在电荷守恒,应为c(Na+)+c(H+)=c(HB-)+2c(B2-)+c(OH-),因此c(Na+)=c(HB-)+2c(B2-),故A错误;B.c(Na+)=0.1molL-1,如HB-完全电离,则c(B2-)=0.1 mol/L,如HB-部分电离,则c(B2-)<0.1 mol/L,因此c(Na+)=0.1molL-1≥c(B2-),故B正确;C.HB-+H2O![]() B2-+H3O+为HB-的电离方程式,故C错误;D.根据题意,浓度为0.1mol/L的NaHB溶液中c(H+)>(OH-),故D错误;故选B。
B2-+H3O+为HB-的电离方程式,故C错误;D.根据题意,浓度为0.1mol/L的NaHB溶液中c(H+)>(OH-),故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成份CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3和ZnSO4溶液的一种工艺流程如下:
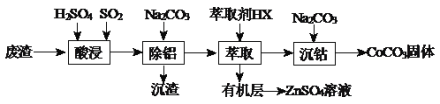
下表是相关金属离子生成氢氧化物沉淀的pH(按金属离子浓度为1.0mol·L-1计算):
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸浸”时发生氧化还原反应的化学方程式________________________。
(2)“除铝”过程中需要调节溶液pH的范围为_________,形成沉渣时发生反应的离子方程式为______________________。
(3)在实验室里,萃取操作用到的玻璃仪器主要有_________________;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______________。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因___________________。
(5)在空气中煅烧CoCO3生成某种钴氧化物和CO2,若充分煅烧一定量CoCO3后测定所得固体质量为2.41g,CO2的体积为0.672L(标准状况),假设固体为纯净物,其化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1mol·L-1的是( )
A.将0.1mol胆矾固体溶于100mL水中
B.将22.4LHCl气体溶于水配成1L溶液
C.将1L10mol·L-1的浓盐酸与9L水混合
D.10gNaOH固体溶解在水中配成250mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各式表示水解反应方程式的是( )
A.HCO3-+H2O![]() H3O++CO32-B.HS-+H2O
H3O++CO32-B.HS-+H2O![]() H2S+OH-
H2S+OH-
C.Cu2++H2O![]() Cu(OH)2↓+2H+D.HCO3-+OH-
Cu(OH)2↓+2H+D.HCO3-+OH-![]() H2O+CO32-
H2O+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2Cl2)主要用作氯化剂或氯磺化剂,也用于制造医药品、染料、表面活性剂等,熔、沸点分别为-54.1℃和69.2℃。

(1)SO2Cl2中S的化合价为______,SO2Cl2在潮湿空气中发生剧烈反应,散发出具有刺激性和腐蚀性的“发烟”,该反应的化学方程式为____________________。
(2)拟用干燥的SO2和Cl2通入如图装置(省略夹持装置)制取磺酰氯。
①仪器A的名称为___________,通水方向为___________(填 “a→b”或“b→a”),装置B的作用是___________。
②反应装置中的活性炭的作用可能为:______________。
③若SO2和Cl2未经干燥,就通入装置中,也散发出具有刺激性和腐蚀性的“发烟”,该反应的化学方程式为_________。
④滴定法测定磺酰氯的纯度:取1.800g产品,加入到100mL0.5000mol·L1NaOH溶液中加热充分水解,冷却后加蒸馏水准确稀释至250mL,取25mL溶液于锥形瓶中,滴加2滴甲基橙,用0.1000mol·L1标准HCl溶液滴定至终点,重复实验三次取平均值,消耗10.00mL。 达到滴定终点的现象为___________,产品的纯度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元
酸HA,溶液pH的变化曲线如图所示。下列说法正确的是

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离常数如表所示:
化学式 | CH3COOH | H2CO3 |
电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
请回答下列问题:
(1)相同pH的CH3COONa、NaHCO3、Na2CO3浓度由大到小的顺序为__________
(2)常温下0.1mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母,下同)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(H+)/c(OH-)
(3)现有10mLpH=2的盐酸溶液,进行以下操作:
a.与pH=5的盐酸等体积混合,则pH=_____________;
b.向该盐酸溶液中加入10mL0.02mol/LCH3COONa溶液,则该混合溶液中存在的物料守恒式为__________________;
c.向该盐酸溶液中加入等体积等浓度的Na2CO3溶液,则混合溶液中存在的电荷守恒式为_______________________;
d. 下列关于体积都为10mL,pH=2的A(盐酸)和B(CH3COOH)溶液说法正确的是_____ (填写序号)。
①与等量的锌反应开始反应时的速率A=B
②与等量的锌反应(锌完全溶解,没有剩余)所需要的时间A>B
③加水稀释100倍,pH大小比较:4=A>B>2
④物质的量浓度大小比较:A>B
⑤分别与10mLpH=12的NaOH溶液充分反应后的溶液pH大小比较:A<B
e. 现用标准HCl溶液滴定氨水,应选用________指示剂,下列操作会导致测定结果偏高的是___。
A.未用HCl标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 1molH2和1molI2在加热条件下充分反应,生成HI的分子数为2NA
B. 10g质量分数为46%的乙醇溶液含有的氢原子数目为0.6NA
C. 20mL0.1 mol/LAlCl3溶液中,水解形成Al(OH)3胶体粒子数为0.002NA
D. 0.1molNa2O2和Na2O的混合物中含有的离子总数等于0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com