
【题目】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:

已知:Ksp ( Li2CO3)=1.6×10-3 。部分物质的溶解度(S)如下表所示:
T℃ | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g |
20 | 1.33 | 34.2 | 0.039 |
80 | 0.85 | 30.5 | —— |
100 | 0.72 | —— |
(1)从“正极”可以回收的金属有___。
(2)写出碱溶时Al箔溶解的离子方程式___。
(3)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池充电时正极的电极反应式为___。
(4)酸浸时产生标准状况下3.36LNO时,溶解 LiFePO4___mol(其他杂质不与HNO3反应),若用H2O2代替HNO3,发生反应的离子方程式为___。
(5)流程中用“热水洗涤”的原因是___。
(6)若滤液②中c(Li+)=4mol/L,加入等体积的Na2CO3后,Li+的沉降率到90%,计算滤液③中c(CO32-)=___mol/L。
(7)“沉淀”时___(填“能”或“不能”)用Na2SO4溶液代替饱和Na2CO3溶液,原因是___。
【答案】Li、Fe、Al 2Al+2OH-+2H2O=2AlO2-+3H2↑ LiFePO4 -e-=FePO4+Li+ 0.45 H2O2+2H++2Fe2+=2Fe3++2H2O或H2O2+8H++2LiFePO4=2Fe3++2H2O+2H3PO4+2Li+ Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的溶解 0.04 不能 Li2SO4为易溶物
【解析】
正极片经碱溶可得到NaAlO2滤液,含有磷酸亚铁锂的滤渣加入硫酸、硝酸,可除去不溶于酸碱的导电剂,得到含有P、Fe、Li的滤液,加入碱液调节pH值,生成的沉淀为FePO4,滤液加入碳酸钠,可生成碳酸锂沉淀,以此解答该题。
(1)根据分析流程,碱溶可得到NaAlO2滤液,调节pH值,生成的沉淀为FePO4,加入碳酸钠,可生成Li2CO3沉淀,可判断从“正极”可以回收的金属;
(2)碱溶时Al箔与氢氧化钠反应生成偏铝酸钠和氢气;
(3)磷酸亚铁锂电池在工作时,正极发生还原反应,电极反应式为:FePO4+e-+Li+= LiFePO4该电池充电时正极变为阳极,失电子发生氧化反应,将放电时正极反应倒写即为阳极电极反应式;
(4)酸浸时HNO3转化为NO,产生标准状况下3.36LNO的物质的量为![]() =0.15mol,产生1molNO,转移3mol电子,则生成0.15molNO转移0.45mol电子,LiFePO4与硝酸反应转化为FePO4,Fe的化合价由+2价变为+3价,溶解1mol LiFePO4转移1mol电子,则转移0.45mol电子,溶解 LiFePO40.45mol;若用H2O2代替HNO3,H2O2与LiFePO4发生氧化还原反应;
=0.15mol,产生1molNO,转移3mol电子,则生成0.15molNO转移0.45mol电子,LiFePO4与硝酸反应转化为FePO4,Fe的化合价由+2价变为+3价,溶解1mol LiFePO4转移1mol电子,则转移0.45mol电子,溶解 LiFePO40.45mol;若用H2O2代替HNO3,H2O2与LiFePO4发生氧化还原反应;
(5)根据表格数据已知条件可得,Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的溶解;
(6)若滤液②中c(Li+)=4mol/L,加入等体积的Na2CO3后,Li+的沉降率到90%,混合后溶液中含有的c(Li+)=4mol/L×(1-90%)×![]() =0.2mol/L,已知:Ksp ( Li2CO3)= c2 (Li+)·c(CO32-)=1.6×10-3,进而计算c(CO32-);
=0.2mol/L,已知:Ksp ( Li2CO3)= c2 (Li+)·c(CO32-)=1.6×10-3,进而计算c(CO32-);
“沉淀”时不能用Na2SO4溶液代替饱和Na2CO3溶液,原因是Li2SO4为易溶物,最终得不到Li2CO3沉淀。
(1)根据分析流程,碱溶可得到NaAlO2滤液,调节pH值,生成的沉淀为FePO4,加入碳酸钠,可生成Li2CO3沉淀,因此从“正极”可以回收的金属有Li、Fe、Al,
答案为:Li、Fe、Al;
(2)碱溶时Al箔与氢氧化钠反应,溶解的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑,
答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)磷酸亚铁锂电池在工作时,正极发生还原反应,电极反应式为:FePO4+e-+Li+= LiFePO4该电池充电时正极变为阳极,失电子发生氧化反应,将放电时正极反应倒写即为阳极电极反应式为LiFePO4=FePO4+Li++e-,
答案为:LiFePO4 -e-=FePO4+Li+;
(4)酸浸时HNO3转化为NO,产生标准状况下3.36LNO的物质的量为![]() =0.15mol,产生1molNO,转移3mol电子,则生成0.15molNO转移0.45mol电子,LiFePO4与硝酸反应转化为FePO4,Fe的化合价由+2价变为+3价,溶解1mol LiFePO4转移1mol电子,则转移0.45mol电子,溶解 LiFePO40.45mol;若用H2O2代替HNO3,H2O2与LiFePO4发生氧化还原反应,反应的离子方程式为H2O2+2H++2Fe2+
=0.15mol,产生1molNO,转移3mol电子,则生成0.15molNO转移0.45mol电子,LiFePO4与硝酸反应转化为FePO4,Fe的化合价由+2价变为+3价,溶解1mol LiFePO4转移1mol电子,则转移0.45mol电子,溶解 LiFePO40.45mol;若用H2O2代替HNO3,H2O2与LiFePO4发生氧化还原反应,反应的离子方程式为H2O2+2H++2Fe2+
答案为:0.45;H2O2+2H++2Fe2+=2Fe3++2H2O或H2O2+8H++2LiFePO4=2Fe3++2H2O+2H3PO4+2Li+;
(5)根据表格数据可得,Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的溶解,
答案为:Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的溶解;
(6)若滤液②中c(Li+)=4mol/L,加入等体积的Na2CO3后,Li+的沉降率到90%,混合后溶液中含有的c(Li+)=4mol/L×(1-90%)×![]() =0.2mol/L,已知:Ksp ( Li2CO3)= c2 (Li+)·c(CO32-)=1.6×10-3,则滤液③中c(CO32-)=
=0.2mol/L,已知:Ksp ( Li2CO3)= c2 (Li+)·c(CO32-)=1.6×10-3,则滤液③中c(CO32-)=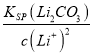 =
=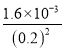 =0.04 mol/L,
=0.04 mol/L,
答案为:0.04;
(7)“沉淀”时不能用Na2SO4溶液代替饱和Na2CO3溶液,原因是Li2SO4为易溶物,最终得不到Li2CO3沉淀,
答案为:Li2SO4为易溶物。


科目:高中化学 来源: 题型:
【题目】“变化观念与平衡思想”是化学学科的核心素养,室温时0.10mol/L草酸钠溶液中存在多个平衡,其中有关说法正确的是(已知室温时,Ksp(CaC2O4)=2.4×10-9)( )
A.若将溶液不断加水稀释,则水的电离程度增大
B.溶液中各离子浓度大小关系c(Na+)>c(C2O42-)>c(OH-)>c(H+)>c(HC2O4-)
C.若用pH计测得溶液的pH=a,则H2C2O4的第二级电离平衡常数Ka2=1013-2a
D.向溶液中加入等体积CaCl2溶液,当加入的CaCl2溶液浓度大于2.4×10-8mol/L时即能产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,等体积、c(H+)相同的盐酸和醋酸溶液分别加水稀释,溶液中的c(H+)随溶液体积变化的曲线如图所示。据图判断下列说法正确的是
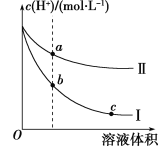
A.曲线Ⅱ表示的是盐酸的变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.取等体积的a点、b点对应的溶液,消耗的NaOH的量相同
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)被称为“21 世纪的清洁燃料”。利用甲醇脱水可制得二甲醚,反应方程式如下: 2CH3OH(g)![]() CH3OCH3(g) + H2O(g) ΔH1
CH3OCH3(g) + H2O(g) ΔH1
(1)二甲醚亦可通过合成气反应制得,相关热化学方程式如下:
2H2(g)+ CO(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
CO(g)+ H2O(g)![]() CO2(g)+ H2(g) ΔH3
CO2(g)+ H2(g) ΔH3
3H2(g)+ 3CO(g)![]() CH3OCH3(g)+ CO2 (g) ΔH4
CH3OCH3(g)+ CO2 (g) ΔH4
则ΔH1= ________(用含有ΔH2、ΔH3、ΔH4的关系式表示)。
(2)经查阅资料,上述反应平衡状态下 Kp 的计算式为:![]() (Kp 为以分压表示的平衡常数,T 为热力学温度)。且催化剂吸附 H2O(g)的量会受压强影响,从而进一步影响催化效率。)
(Kp 为以分压表示的平衡常数,T 为热力学温度)。且催化剂吸附 H2O(g)的量会受压强影响,从而进一步影响催化效率。)
①在一定温度范围内,随温度升高,CH3OH(g)脱水转化为二甲醚的倾向_______ (填“增大”、“不变”或“减小”)。
②某温度下(此时 Kp=100),在密闭容器中加入CH3OH,反应到某时刻测得各组分的分压如下:
物质 | CH3OH | CH3OCH3 | H2O |
分压/MPa | 0.50 | 0.50 | 0.50 |
此时正、逆反应速率的大小:v正 ____v逆 (填“>”、 “<”或“=”)。
③200℃时,在密闭容器中加入一定量甲醇 CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为 _______(填标号)。
A.<![]() B.
B.![]() C.
C.![]() ~
~![]() D.
D.![]() E.>
E.>![]()
④300℃时,使 CH3OH(g)以一定流速通过催化剂,V/F (按原料流率的催化剂量)、压强对甲醇转化率影响如图1所示。请解释甲醇转化率随压强(压力)变化的规律和产生这种变化的原因,规律__________________________,原因_______________________。

(3)直接二甲醚燃料电池有望大规模商业化应用,工作原理如图2所示。
①该电池的负极反应式为:_______________。
②某直接二甲醚燃料电池装置的能量利用率为 50%,现利用该燃料电池电解氯化铜溶液,若消耗 2.3g 二甲醚,得到铜的质量为_______ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时c(CO2) 随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时c(CO2) 随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
A.该反应的ΔH>0、ΔS<0
B.体系的总压强p:p(Ⅰ)>p(Ⅲ)
C.平衡常数:K(Ⅰ)>K(Ⅱ)
D.T1K时,Ⅳ点所处的状态中v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含锂废渣(主要金属元素的含量:Li 3.50% Ni 6.55% Ca 6.41% Mg 13.24%)制备Li2CO3,并用其制备Li+电池的正极材料LiFePO4。部分工艺流程如下:
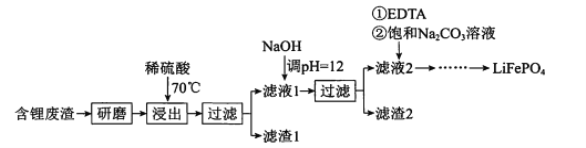
资料:ⅰ滤液1、滤液2中部分两者的浓度(g/L)

ⅱEDTA能和某些二价金属离子形成稳定的水溶性络合物。
ⅲ某些物质溶解度(S):
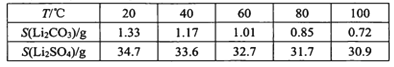
I.制备Li2CO3粗品
(l)上述流程中为加快化学反应速率而采取的措施是 ___。
(2)向滤液2中先加入EDTA,再加入饱和Na2CO3溶液,90℃充分反应后,分离出 固体Li2CO3粗品的操作是 ______。
(3)处理lkg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是 ____g。(摩尔质量:Li 7 g.mol-l Li2CO3 74 g.mol-l)
II.纯化Li2CO3粗品
(4)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO3溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是 _______。
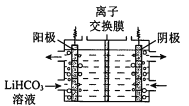
III.制备LiFePO4
(5)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随加水体积变化的曲线如图所示。下列说法正确的是
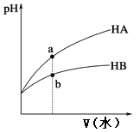
A. HB的酸性强于HA
B. a点溶液的导电性大于b点溶液
C. 同浓度的NaA与NaB溶液中,c(A-)=c(B-)
D. 加水稀释到pH相同时,酸HA、HB用到的水V(A)小于V(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
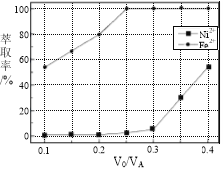
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
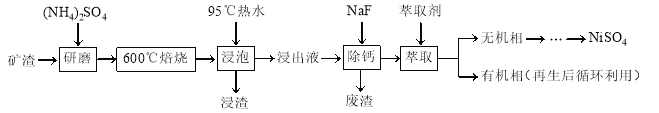
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是______________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为______________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有______________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的________倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为______________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________ mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ·mol-1,CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ·mol-1。现有H2与CH4的混合气体112L(标准状况下),使其完全燃烧生成CO2(g)和H2O(l),若实验测得反应放热3845.8kJ,则原混合气体中H2与CH4的物质的量之比是( )
A.1:1B.1:3C.1:4D.2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com