
【题目】(1)某质量数为52,核内有28个中子的原子,其价电子排布图是_______________,该原子中有______个未成对电子,这些未成对电子具有___________(填“相同”或“不同”)的自旋方向;
(2)氨的沸点_____(填“高于”或“低于”)膦(PH3);GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________;
(3)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+ ___________颜色(填“无”或“有”)。
(4)Cu与O形成的某种化合物F,其晶胞结构如下图所示。原子坐标参数P(x,y,z)可以表示晶胞内部各原子的相对位置。例如F晶胞中原子坐标参数a为(0,0,0);b为(1,0,0)等,则c原子的坐标参数为______ 。
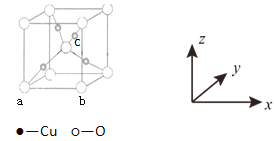
【答案】 1s22s22p63s23p63d54s1 6 相同 高于 GaF3是离子晶体,GaCl3是分子晶体,离子晶体GaF3的熔沸点高 有 (3/4,1/4,3/4)
【解析】
(1)由于某原子的质量数为52,中子数为28,则其质子数为Z=质量数-中子数=52-28=24,原子核外电子的排布遵循能量最低原理、泡利原理、洪特规则,所以该原子的核外电子排布为:1s22s22p63s23p63d54s1,该原子中有5个未成对电子,这些未成对电子具有相同的自旋方向;
(2)氨分子间存在特殊的分子间作用力氢键,而膦中不含有分子间氢键,因此氨分子的沸点高于膦分子的沸点;GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是GaF3为离子晶体,GaCl3为分子晶体,离子晶体的熔点一般高于分子晶体;
(3)Mn2+离子的原子核外排布式为1s22s22p63s23p63d5,其d轨道上有5的电子,故[Mn(H2O)6]2+有颜色;
(4)已知晶胞中原子坐标参数a为(0,0,0),b的原子坐标分别为(b,0,0),则以a为晶胞坐标原点,晶胞的边长为1,则c的坐标参数为(3/4,1/4,3/4)。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某溶液X中可能含有下列离子中的若干种:Cl、SO42、SO32、HCO3、Na+、Mg2+、Fe3+,为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验,下列说法不正确的是

A. 气体A可能是CO2或SO2
B. 溶液X中一定存在SO42
C. 溶液X中一定不存在Fe3+和Mg2+,可能存在Na+
D. 向溶液A加入硝酸酸化的硝酸银溶液可能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )
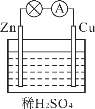
①Zn是负极 ②电子由Zn经外电路流向Cu
③Zn极:Zn-2e-= Zn2+ ④Cu极:Cu2++2e-= Cu
A. ①②B. ①③C. ①②③D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合形成稳定化合物的是( )
A.10与19B.6与16
C.11与17D.14与8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二氯化二硫(S2Cl2)为橙黄色液体,遇水易水解,工业上用于橡胶的硫化。某学习小组用氯气和硫单质合成S2Cl2的实验装置如图所示.下列说法正确的是
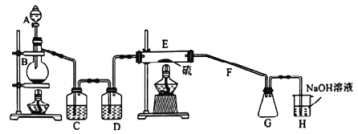
A. 实验时需先点燃E处的酒精灯
B. C、D中所盛试剂为饱和氯化钠溶液、浓硫酸
C. 二氯化二硫(S2Cl2)水解反应产物为:S、H2S、HCl
D. G中可收集到纯净的产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为
A. 4v(NH3)=5v(O2) B. 5v(O2)=6v(H2O)
C. 2v(NH3)=3v(H2O) D. 4v(O2)=5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬的铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,为实现铬和铝的再生利用。其工作流程如下:
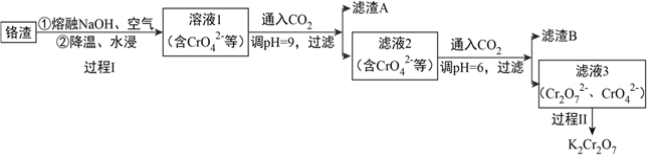
(1)铝热法冶炼金属铬,是利用了金属铝的__________(填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有CrO42-、______、_______。
(3)过程I,在Cr2O3参与的反应中,若生成0.4molCrO42-,消耗氧化剂的物质的量是__________。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是____________________。
②滤渣B受热分解所得物质的参与循环利用,B是__________。
③已知:2CrO42-+2H+ ![]() Cr2O72-+H2O K=4.0×1014
Cr2O72-+H2O K=4.0×1014
滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是__________mol/L。
(5)过程II的目的是得到K2Cr2O7粗品。
不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程II的操作是:__________________________,过滤,得到K2Cr2O7粗品。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com