
【题目】已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为
A. 4v(NH3)=5v(O2) B. 5v(O2)=6v(H2O)
C. 2v(NH3)=3v(H2O) D. 4v(O2)=5v(NO)
科目:高中化学 来源: 题型:
【题目】《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是( )
A.蒸馏B.升华C.过滤D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某质量数为52,核内有28个中子的原子,其价电子排布图是_______________,该原子中有______个未成对电子,这些未成对电子具有___________(填“相同”或“不同”)的自旋方向;
(2)氨的沸点_____(填“高于”或“低于”)膦(PH3);GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________;
(3)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+ ___________颜色(填“无”或“有”)。
(4)Cu与O形成的某种化合物F,其晶胞结构如下图所示。原子坐标参数P(x,y,z)可以表示晶胞内部各原子的相对位置。例如F晶胞中原子坐标参数a为(0,0,0);b为(1,0,0)等,则c原子的坐标参数为______ 。
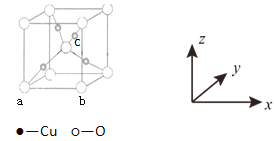
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的1/2。下列说法不正确的是( )
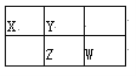
A. Z元素位于周期表的第三周期第VA族
B. X、W元素的最高价氧化物对应水化物的酸性:W强于X
C. Y元素的气态氢化物的热稳定性比Z的高
D. X与W形成共价化合物XW2, X的原子半径比Y小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA表示阿伏加德罗常数,下列说法正确的是( )
A. 12g石墨中含有C-C键的个数为3NA
B. 7.8gNa2O2晶体中含有阴阳离子总数为0.4NA
C. 1molSiO2晶体中含有4NA个Si-O键
D. 78g苯中含![]() 键的数目为3NA
键的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)已知反应NO2(g)+CO(g) = NO(g) +CO2(g)的能量变化如图所示,下列说法正确的是________。
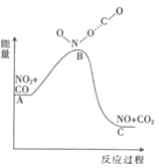
A.图中A→B的过程为放热过程
B.1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和
C.该反应为氧化还原反应
D.1molNO2(g)和1molCO(g)的总能量低于1molNO(g)和1molCO2(g)的总能量
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
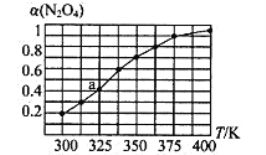
①由图推测该反应的△H___0(填“>”或“<”),理由为________________。
②图中a点对应温度下,已知N2O4的起始压强为108 kPa,则该温度下反应的平衡常数Kp=_________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___________,在下左图上标出的点中,能表示反应达到平衡状态的点为__________(填字母代号)。

(3)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。
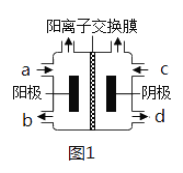
①收集到(CH3)4NOH的区域是______(填a、b、c或d)。
②写出电解池总反应(化学方程式)___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的( )
A. 实验室用固体氯化铵和熟石灰共热制取NH3:2NH4++Ca(OH)2![]() 2NH3↑+ Ca2++2H2O
2NH3↑+ Ca2++2H2O
B. 铜与浓硝酸反应: 3Cu + 8H+ + 2NO3- =3Cu2+ + 2NO↑ + 4H2O
C. 氨水与FeCl3反应:3OH- + Fe3+ =Fe(OH)3↓
D. 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O===2HCO![]() +SO32-
+SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室做乙醛和银氨溶液发生银镜反应的实验时:
(1)为产生光亮的银镜,试管应先用______溶液煮沸,倒掉煮沸液后再用清水将试管冲洗干净。
(2)配制银氨溶液时向盛有__________溶液的试管中逐滴滴加__________溶液边滴边振荡直到__________为止。有关化学反应的离子方程式为:①_____________________;②_________________________。
(3)加热时应用________加热,产生银镜的化学方程式:____________________。
(4)实验室配制银氨溶液时若向AgNO 3 溶液中加入氨水形成银氨溶液时,应防止加入氨水过量,否则容易生成容易爆炸的________,试剂本身也失去灵敏性。配制好的银氨溶液不可久置,否则会生成________,从溶液中析出这种沉淀,哪怕是用玻璃棒刮擦也会分解发生猛烈的爆炸。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com