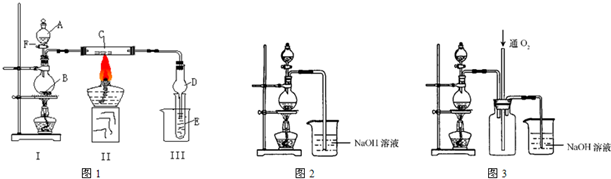
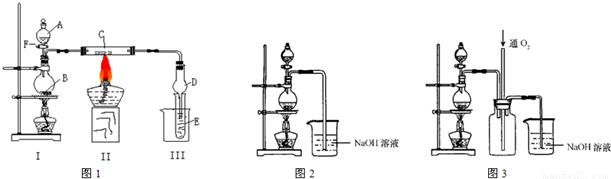
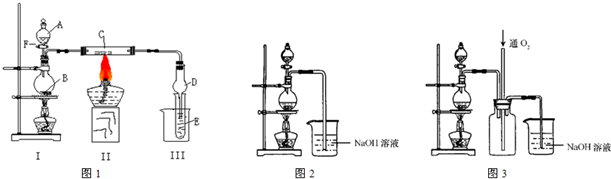
解:(I)二氧化锰与浓盐酸反应生成氯化锰、氯气、水,反应离子方程式为MnO
2+4H
++2Cl
-
Mn
2++Cl
2↑+2H
2O.
实验一段时间后,C、D中有红棕色烟,红棕色烟应是FeCl
3,氯气与物质C反应生成FeCl
3,故物质C为Fe.
故答案为:MnO
2+4H
++2Cl
-
Mn
2++Cl
2↑+2H
2O;Fe.
(II)(1)由题目信息,实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,故图2分液漏斗中装的液体为浓硝酸.
故答案为:浓硝酸.
(2)硝酸过量制得的硫酸铜晶体中含有硝酸铜,制得的硫酸铜晶体不纯.
故答案为:制得的硫酸铜晶体不纯.
(3)反应中产生的尾气主要为NO,由于NO与NaOH溶液不反应,故应向氢氧化钠溶液中通入空气(氧气),装置3中在尾气吸收装置之前连接集气瓶,通入氧气有利于氮氧化合物的吸收,同时起安全瓶作用,防止倒吸.
故答案为:有利于氮氧化合物的吸收;防止倒吸.
(4)①高温灼烧固体应在坩埚中进行,方案1将铜粉在坩埚中反复灼烧,因此仪器应为坩埚.
故答案为:坩埚.
②由于溶液酸性较强,欲使Fe
3+沉淀,需加入某种试剂降低c(H
+)浓度,但又不能引入新杂质.
a.CuO降低c(H
+)浓度,不引入新杂质,过量的CuO可以过滤除去,故a正确;
b.CuCO
3 降低c(H
+)浓度,不引入新杂质,过量的CuCO
3 可以过滤除去,故b正确;
c.CaCO
3 引入钙离子,故c错误;
d.NaOH引入钠离子,故d错误.
故选:ab.
③由题目信息可知,氧气直接通入到铜粉与稀硫酸的混合物,发生反应生成硫酸铜与水,
反应方程式为2Cu+O
2+2H
2SO
4
2CuSO
4+2H
2O.
故答案为:2Cu+O
2+2H
2SO
4
2CuSO
4+2H
2O.
分析:(I)二氧化锰与浓盐酸反应生成氯化锰、氯气、水.实验一段时间后,C、D中有红棕色烟,红棕色烟应是FeCl
3,即氯气与物质C反应生成FeCl
3,据此物质C.
(II)(1)由题目信息,实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,判断图2分液漏斗中装的液体.
(2)硝酸过量制得的硫酸铜晶体中含有硝酸铜.
(3)装置3中在尾气吸收装置之前连接集气瓶,通入氧气有利于氮氧化合物的吸收,同时起安全瓶作用.
(4)①高温灼烧固体应在坩埚中进行.
②加入甲物质,目的是调节PH值,使Fe
3+转化Fe(OH)
3沉淀,且不能引入新杂质.
③由题目信息可知,氧气直接通入到铜粉与稀硫酸的混合物,发生反应生成硫酸铜与水.
点评:考查学生对实验原理的理解、实验方案的评价、实验装置的理解与评价、常用化学用语、物质推断、实验条件控制等,难度中等,实验方案设计,应根据实验目的思考实验原理,根据实验原理中反应物的状态和反应条件确定试剂和装置,通过比较和评价优选最佳实验方案.

 Mn2++Cl2↑+2H2O.
Mn2++Cl2↑+2H2O. Mn2++Cl2↑+2H2O;Fe.
Mn2++Cl2↑+2H2O;Fe. 2CuSO4+2H2O.
2CuSO4+2H2O. 2CuSO4+2H2O.
2CuSO4+2H2O.