
【题目】属于放热反应的是
A.氢气还原氧化铜B.氨气的分解C.氢气在氧气中燃烧D.碳酸钙高温分解
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】干燥的氨气在高温下能被氧化铜氧化,生成两种单质和一种化合物。完成上述反应可选用下列装置进行。
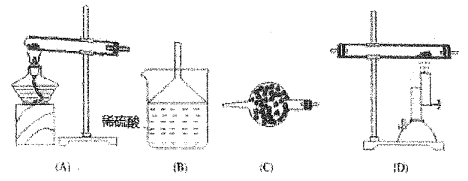
(1)当气体流向从左到石时,仪器连接的顺序是___________。
(2)装置B中试剂的作用是_________,装置C的作用是______。
(3)装置D 中反应的化学方程式是__________。
(4)装置A 中反应的化学方程式是_________ 。
(5)若实验室要收集氨气,选择E装置时,棉花的作用为_________,选择F 装置时,氨气应从______口进。
(6)工业制备氨气的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为K= ![]() ,已知1100℃时K=0.263
,已知1100℃时K=0.263
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值;平衡常数K值(选填“增大”“减小”或“不变”)
(2)1100℃时测得高炉中c(CO2)=0.025molL﹣1、c(CO)=0.1molL﹣1 , 在这种情况下,该反应是否处于化学平衡状态(选填“是”或“否”),此时,化学反应速率是v(正)v(逆)(选填“大于”“小于”或“等于”),其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】U、V、W、Y、Z是原子序数依次增大的短周期主族元素,U、Y在周期表中的相对位置如图1;U元素与氧元素能形成两种无色气体;W是地壳中含量最多的金属元素.
(1)元素Z在周期表中位于第族.我国首创以W组成的金属﹣海水﹣空气电池作为能源的新型海水标志灯,它以海水为电解质溶液,靠空气中的氧气使W组成的金属不断氧化而产生电流.只要把灯放入海水中数分钟,就会发出耀眼的白光.则该电源负极反应为 .
(2)YO2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VO,有关反应的离子方程式为 , 由此可知YO2和VO还原性较强的是(写化学式) .
(3)V的最简单气态氢化物甲的水溶液显碱性.①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为 .
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变如表中反应条件x,该平衡体系中随x递增y递增的是(选填序号).
选项 | a | b | c | d |
x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
③向含4molV 的最高价含氧酸的稀溶液中,逐渐加入Fe粉至过量.假设生成的气体只有一种,请在图2坐标系中画出n(Fe2+)随n(Fe)变化的示意图 .
(4)相同温度下,等体积、物质的量浓度都为0.1mol/L的KZ和CH3COOK溶液的两种溶液中,离子总数相比较 .
A.前者多
B.一样多
C.后者多
D.无法判断.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成下面题目:
(1)X基态原子的M层与K层电子数相等,则X所在周期中第一电离能最大的元素是 .
(2)①Y2+离子的3d轨道中有9个电子,基态Y原子的价电子排布式为
②将Y粉末加入NH3的浓溶液中,通入O2 , 充分反应后溶液呈深蓝色,发生如下反应:
2Y+8NH3H2O+O2=2[Y(NH3)4](OH)2+6H2O,该过程中形成的化学键类型有
a金属键 b离子键 c极性键 d非极性键 e配位键 f氢键 g范德华力
(3)K2Cr2O7是一种常见的强氧化剂,酸性条件下会被还原剂还原成Cr3+ . Cr3+能与OH﹣、CN﹣形成配合物[Cr(OH)4]﹣、[Cr(CN)6]3﹣ .
①不考虑空间构型,[Cr(OH)4]﹣的结构可用示意图表示为(若有配位键,用箭号表示)
②一种新型阳极材料LaCrO3的晶胞如图1所示,已知距离每个Cr原子最近的O原子有6个,则图中原子代表的是Cr原子(填A、B、C).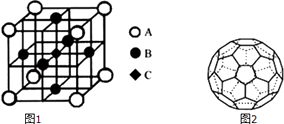
(4)碳的一种单质结构如图2所示,其相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环.则该单质中碳原子的杂化方式是 , 1mol该单质中存在的π键数目为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 根据酸分子中含有的氢原子个数可将酸分为一元酸、二元酸、三元酸等
B. 碱性氧化物一定是金属氧化物
C. SO2的水溶液能导电,所以SO2是电解质
D. 金刚石不导电,因此金刚石是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料.通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450﹣500℃),四氯化硅经提纯后用氢气还原可得高纯硅.以下是实验室制备四氯化硅的装置示意图.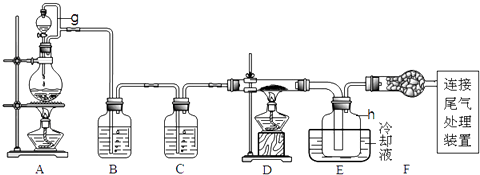
查阅相关资料获悉:
a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | ﹣ | 315 | ﹣ |
熔点/℃ | ﹣70.0 | ﹣ | ﹣ | ﹣ |
升华温度/℃ | ﹣ | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式 .
(2)装置A中g管的作用是;装置C中的试剂是;装置E中的h瓶需要冷却理由是 .
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,含有铁、铝等元素的杂质.为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+ , 再用KMnO4标准溶液在酸性条件下进行氧化还原反应滴定,锰元素被还原为Mn2+ . ①写出用KMnO4滴定Fe2+的离子方程式:;
②滴定前是否要滴加指示剂?(填“是”或“否”),判断滴定终点的方法是 .
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml试样溶液,用1.000×10﹣2molL﹣1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 . 若滴定前平视,滴定后俯视KMnO4液面,对测定结果有何影响(填“偏高”、“偏低”、或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO2 (红棕色)N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( ) 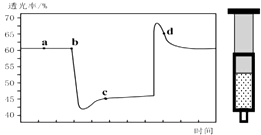
A.b点的操作是压缩注射器,平衡正向移动
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.d 点:v(正)>v(逆)
D.若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com