
【题目】要从乙酸的乙醇溶液中回收乙酸,合理的操作组合是( ) ①蒸馏 ②过滤 ③静置分液 ④加足量钠 ⑤加入足量H2SO4 ⑥加入足量NaOH溶液 ⑦加入乙酸与浓H2SO4混合液后加热
⑧加入浓溴水.
A.⑦③
B.⑧⑤②
C.⑥①⑤②
D.⑥①⑤①
科目:高中化学 来源: 题型:
【题目】在FeCl3和CuCl2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示。则该溶液中FeCl3与CuCl2的物质的量浓度之比为

A. 3∶1 B. 1∶2 C. 2∶1 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月的eLife上发表了浙江医科大学第二医院和浙江大学肿瘤研究所的晁明和胡汛等人的一篇论文。媒体以“用十几块钱的小苏打饿死了癌细胞”为题予以报道,报道曲解了小苏打的作用,但小苏打在他们治疗癌症的方法中确实功不可没。在实验室中模拟工业制取NaHCO3的实验步骤如下:
①连接好装置,检验气密性,在仪器内装入药品。
②先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
③分离C中所得的混合物,得到NaHCO3固体。
④向滤液中加入适量的NaCl固体粉末,有NH4Cl晶体析出。
(1)下图所示装置的连接顺序是:a接___,________接__________;b接____(填接口编号)。___________

(2)A中反应的离子方程式为_____________________;B中常选用的液体反应物为_______;D中应选用的液体为_______。
(3)步骤②让______装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是________________;装有无水CaCl2的U形管的作用是_____________________。
(5)步骤③分离出NaHCO3固体的操作是_________。
(6)步骤④中所得的晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的 实验,不使用其他任何试剂,证明所得晶体大部分是NH4C1。简要写出操作和现象__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:

请回答下列问题:
(1)溶液A转化为溶液D发生的离子方程式为________________________。
(2)由物质M制取铝的化学方程式为________________________________。
(3)溶液D中通入过量CO2生成沉淀F的离子方程式为_________________。
(4)沉淀C的成分是____________ ,逐滴向少量沉淀C中加入过量盐酸,此过程的实验现象为_________________________________。
(5)把Al2O3加入足量苛性钠溶液中发生的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA为阿伏加德罗常数的值)()
A.28g氮气含有的原子数为NA
B.24gO2分子和24gO3分子所含的氧原子数目相等
C.4g Ca的物质的量为1mol
D.1mol氧气分子的质量等于1mol氧原子的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关叙述正确的是
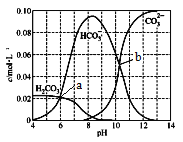
A. b点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B. 随pH增大,![]() 数值先减小后增大
数值先减小后增大
C. 25℃时,碳酸的第一步电离常数Ka1=10-6
D. 溶液呈中性时:c(HCO3- )>c(Cl-)>c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅单质化学性质不活泼,但常温下能与强碱溶液反应,下面几种含硅元素的物质之间的相互转化关系如图所示:

(1)写出图示反应的几种物质的化学式:
B____________,C____________,D________________。
(2)写出下列反应的化学方程式:
①B→A:_________________________________________________;
②B→E:______________________________________________________。
(3)写出下列溶液中反应的离子方程式:
D→C:___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铝(AlP)通常可作为一种广谱性熏蒸杀虫剂,吸水后会立即产生高毒性PH3气体(沸点-89.7℃,还原性强)。某化学兴趣小组的同学用下述方法测定粮食中残留磷化物的含量。

在C中加入l00g原粮,E中加入20.00mL l.50×l0-3 mol·L-1 KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的KMnO4溶液。
回答下列问题:
(1)仪器D的名称是____________________________________。
(2)AlP与水反应的化学方程式为______________________________________________。
(3)装置A中盛装KMnO4溶液的作用是除去空气中的还原性气体,装置B中盛有焦性没食子酸的碱性溶液,其作用是__________________。
(4)通入空气的作用是_____________________________。
(5)装置E中PH3被氧化成磷酸,则装置E中发生反应的氧化剂和还原剂物质的量之比为___________________________。
(6)收集装置E中的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用4.0×l0-4 mol·L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液15.00mL,Na2SO3与KMnO4溶液反应的离子方程式为:________________________________,则该原粮中磷化物(以PH3计)的含量为________________mg·kg-1(写计算表达式和计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%.在此平衡体系中加入1molZ(g),恒定温度条件下,在平衡后X、Y、Z的体积分数不变.下列叙述正确的是( )
A.第二次平衡时,Z的浓度为0.2 molL﹣1
B.m=3
C.X与Y的平衡转化率之比为1:2
D.加入Z后平衡没移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com