
| m |
| M |
| V |
| Vm |
| N |
| NA |
| m g |
| M g/mol |
| m |
| M |
| m |
| M |
| m |
| M |
| 2mNA |
| M |
| 2mNA |
| M |
| m |
| M |
| 22.4m |
| M |
| 22.4m |
| M |
| mg |
| (1000+m)g |
| m |
| 1000+m |
| m |
| 1000+m |
| ||
| V L |
| m |
| MV |
| m |
| MV |
| m |
| MV |
| 0.1m |
| MV |
| 0.1m |
| MV |


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案科目:高中化学 来源: 题型:
| A、Zn|H2SO4(稀)|Fe |
| B、Cu|AgNO3(aq)|Ag |
| C、Zn|CCl4|Cu |
| D、Fe|H2SO4(稀)|C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 4 |
| 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
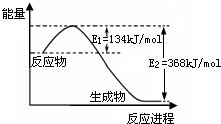 氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| a | |||||||
| b | c | ||||||
| d | e | f | |||||
| 名称 | 常温时的状态 | 结构简式 | 熔点/.C | 沸点/.C | 相对密度 |
| 甲烷 | 气 | CH4 | -l82.5 | -161.5 | |
| 乙烷 | 气 | CH3CH3 | -l82.8 | -88.6 | |
| 丙烷 | 气 | CH3CH2CH3 | -188.0 | -42.1 | 0.5005 |
| 戊烷 | 液 | CH3(CH2)3CH3 | -129.7 | 36.0 | 0.5572 |
| 癸烷 | 液 | CH3(CH2)3CH3 | -29.7 | 172.1 | 0.7298 |
| 十七烷 | 固 | CH3(CH2)15CH3 | 22 | 302.2 | 0.7767 |
查看答案和解析>>
科目:高中化学 来源: 题型:
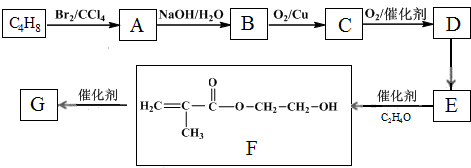
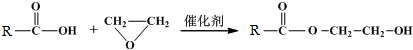
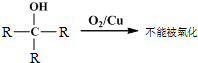
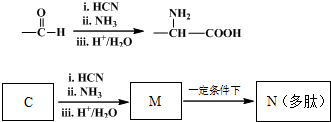
查看答案和解析>>
科目:高中化学 来源: 题型:
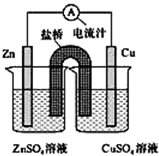 如图为一原电池的装置示意图,下列说法不正确的是( )
如图为一原电池的装置示意图,下列说法不正确的是( )| A、原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu |
| B、原电池工作时,电流由铜极流经电流计流向锌极 |
| C、原电池工作时,盐桥中K+移向CuSO4溶液 |
| D、如果将Cu电极与Zn电极互换,电流计指针反向偏转 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com