��������1�����ݰ�����Ũ�ȼ��㵪����Ũ�ȱ仯����������ת����=
��100%��
��2�����������仯ͼ����Ӧ�ȵ�������Ӧ�Ļ�ܼ�ȥ�淴Ӧ�Ļ�ܣ�
��3�����ݸ�˹���ɹ���Ŀ���Ȼ�ѧ����ʽ���ݴ˼���ȼ���ȣ�ע�ⰱ����ϵ��Ϊ1�����ɵ�ˮΪҺ̬��
��4������������ˮ��Ӧ���������һ�����������ݻ��ϼ۵ı仯��Ϸ���ʽ���㣻
��5�����ø�˹���ɼ��㷴Ӧ�ȣ��õ�ƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��䣬�ɴ�������һЩ������Ҳ���䣬����ƽ��ʱ�����ʵ�Ũ�ȣ��ɼ���ƽ�ⳣ����
���
�⣺��1��10min��ƽ�⣬��ð�����Ũ��Ϊ0.4mol/L��������Ũ�ȱ仯��Ϊ0.4mol/L��
=0.2mol/L���ʵ�����ת����=
��100%=10%��
�ʴ�Ϊ��10%��
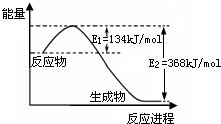
��2���÷�Ӧ���ʱ��H=E
1-E
2=134KJ/mol-368KJ/mol=-234KJ/mol�������Ȼ�ѧ����ʽΪNO
2��g��+CO��g��=CO
2��g��+NO��g����H=-234kJ?mol
-1��
�ʴ�Ϊ��NO
2��g��+CO��g��=CO
2��g��+NO��g����H=-234kJ?mol
-1��
��3��NH
3��g��ȼ�յķ���ʽΪ4NH
3��g��+7O
2��g���T4NO
2��g��+6H
2O��l������֪��
��2H
2��g��+O
2��g���T2H
2O��l����H=-483.6kJ/mol
��N
2��g��+2O
2��g���T2NO
2��g����H=+67.8kJ/mol
��N
2��g��+3H
2��g���T2NH
3��g����H=-92.0kJ/mol
���ݸ�˹���ɣ����2-���2+���3�ã�4NH
3��g��+7O
2��g���T4NO
2��g��+6H
2O��l����
��H=2��67.8kJ/mol-2����-92.0kJ/mol��+3����-483.6kJ/mol��=-1131.2kJ/mol��
�ʰ�����ȼ����Ϊ
=282.8kJ/mol��
�ʴ�Ϊ��282.8kJ/mol��
��4������������ˮ��Ӧ���������һ����������Ӧ�Ļ�ѧ����ʽΪ3NO
2+H
2O=2HNO
3+NO����Ӧ6NO
2+8NH
37N
2+12H
2O�У�6NO
2��NԪ�ػ��ϼ۽��ͣ���+4�۽��͵�0�ۣ���6molNO
2�μӷ�Ӧ��ת��24mol���ӣ����Ե�ת��1.2mol����ʱ������NO
20.3mol�����Ϊ6.72L���ʴ�Ϊ��6.72��
��5����֪����2SO
2��g��+O
2��g��?2SO
3��g����H=-196.6kJ?mol
-1��2NO��g��+O
2��g��?2NO
2��g����H=-113.0kJ?mol
-1�����ø�˹���ɽ��١�
-�ڡ�
���õ��Ȼ�ѧ����ʽΪ��NO
2��g��+SO
2��g��?SO
3��g��+NO��g��
��H=
����-196.6kJ?mol
-1��-
����-113.0kJ?mol
-1��=-41.8kJ?mol
-1��
a�������Ƿ�ﵽƽ�⣬��ϵѹǿ�����ֲ��䣬���������ж��Ƿ�ﵽƽ��״̬����a����
b�����������ɫ���ֲ��䣬˵��Ũ�Ȳ��䣬�ﵽƽ��״̬����b��ȷ��
c��SO
3��NO�ļ�����֮��Ϊ1��1�������Ƿ�ﵽƽ�⣬���ߵ�����ȱ��ֲ��䣬�����ж��Ƿ�ﵽƽ��״̬����c����
d�����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ���ÿ����1mol SO
3��ͬʱ����1molNO
2�������ж��Ƿ�ﵽƽ��״̬����d����
��������b��ȷ��
NO
2��g��+SO
2��g��?SO
3��g��+NO��g��
��ʼ���ʵ���� a 2a 0 0
ת�����ʵ���� x x x x
ƽ�����ʵ���� a-x 2a-x x x
ƽ��ʱNO
2��SO
2�����Ϊ1��6������1a-x������2a-x��=1��6����x=
a����ƽ�ⳣ��K=
=
=
=
��
�ʴ�Ϊ��-41.8��b��
��

 ���ǵ����Ϻ����ḻ��һ��Ԫ�أ��䵥�ʼ��������ڹ�ũҵ������������������Ҫ���ã�
���ǵ����Ϻ����ḻ��һ��Ԫ�أ��䵥�ʼ��������ڹ�ũҵ������������������Ҫ���ã�


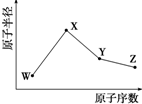 W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ���ԭ�Ӱ뾶��ԭ�������仯��ͼ��ʾ����֪W��һ�ֺ��ص�������Ϊ18��������Ϊ10��X��Neԭ�ӵĺ�����������1��Y�ĵ�����һ�ֳ����İ뵼����ϣ�Z��ԭ�Ӱ뾶��ͬ��������Ԫ������С��
W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ���ԭ�Ӱ뾶��ԭ�������仯��ͼ��ʾ����֪W��һ�ֺ��ص�������Ϊ18��������Ϊ10��X��Neԭ�ӵĺ�����������1��Y�ĵ�����һ�ֳ����İ뵼����ϣ�Z��ԭ�Ӱ뾶��ͬ��������Ԫ������С��