
| A、CH3CH2OH和CH3-O-CH3 |
| B、H2NCH2COOH和CH3CH2NO2 |
| C、CH3CH2COOH和CH3COOCH3 |
| D、CH3CH3和CH3CH2CH3 |


科目:高中化学 来源: 题型:
| A、20g | B、50g/mol |
| C、50 | D、60g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X原子、Y原子分别形成离子时,X原子得到电子数目比Y原子多 |
| B、X单质能与Y的气态氢化物反应生成Y的单质 |
| C、两元素的气态氢化物分别溶水后,溶液的酸性X比Y强 |
| D、X元素的最高正化合价高于Y元素的最高正化合价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可能有SO42- 或Ag+ |
| B、一定有SO42- |
| C、一定无Ag+ |
| D、还可能有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn|H2SO4(稀)|Fe |
| B、Cu|AgNO3(aq)|Ag |
| C、Zn|CCl4|Cu |
| D、Fe|H2SO4(稀)|C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在c(H+)=1.0×10-13mol?L-1的溶液中:Na+、S2-、AlO2-、SO32- | ||||
| B、含有0.1 mol?L-1 Fe2+的溶液:Na+、ClO-、SO42-、Cl- | ||||
C、含有0.1 mol?L-1HCO
| ||||
D、强酸性溶液:K+、Al3+、NO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28g氮气所含有的原子数目为NA |
| B、标准状况下,22.4LH2O含有的分子数为 NA |
| C、NA 个CO2分子占有的体积一定为22.4L |
| D、标准状况下,22.4L H2和O2混合气所含的分子数一定等于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2,2-二甲基丁烷的一氯代物有3种 |
| B、乙烯与苯都存在碳碳双键 |
| C、可用酸性KMnO4溶液鉴别苯、甲苯、己烯与四氯化碳 |
| D、等物质的量的乙烯与乙醇完全燃烧时,其耗氧量不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
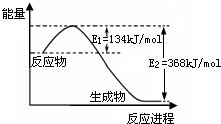 氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.| 催化剂 |
| 加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com