
【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | Ⅷ | ||||||
① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
② | ③ | ④ | ⑧ | ||||
⑤ | ⑥ | ⑦ | ⑨ | ||||
请按要求回答下列问题.
(1)化学性质最不活泼的元素的原子结构示意图为
(2)⑥④⑦的氢化物的稳定性最强的是:(写氢化物的化学式);
(3)元素③④⑤形成的离子半径由大到小的顺序是(用离子符号表示)
(4)用电子式表示元素⑤与⑦的化合物的形成过程: .
【答案】
(1)![]()
(2)H2O
(3)N3﹣>O2﹣>Na+
(4)![]()
【解析】解:根据①~⑨九种元素在周期表中的位置知,它们分别是H、C、N、O、Na、P、S、Ne、Cl元素,(1)稀有气体原子最外层电子达到稳定结构,其性质最不活泼,所以这几种元素中最不活泼的是Ne元素,其原子核内有10个质子、核外有2个电子层且最外层有8个电子,其原子结构示意图为 ![]() ,所以答案是:
,所以答案是: ![]() ;(2)元素的非金属性越强,其氢化物的稳定性越强,⑥④⑦的非金属性强弱顺序是O>S>P,所以氢化物的稳定性最强的是H2O,所以答案是:H2O;(3)电子层结构相同的离子,离子半径随着原子序数增大而减小,这三种离子半径大小顺序是,所以答案是:N3﹣>O2﹣>Na+ , 所以答案是:N3﹣>O2﹣>Na+;(4)⑤与⑦分别是活泼金属元素和活泼非金属元素,二者通过得失电子形成离子化合物硫化钠,其形成过程为
;(2)元素的非金属性越强,其氢化物的稳定性越强,⑥④⑦的非金属性强弱顺序是O>S>P,所以氢化物的稳定性最强的是H2O,所以答案是:H2O;(3)电子层结构相同的离子,离子半径随着原子序数增大而减小,这三种离子半径大小顺序是,所以答案是:N3﹣>O2﹣>Na+ , 所以答案是:N3﹣>O2﹣>Na+;(4)⑤与⑦分别是活泼金属元素和活泼非金属元素,二者通过得失电子形成离子化合物硫化钠,其形成过程为 ![]() ,所以答案是:
,所以答案是: ![]() .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,甲、乙、丙、丁四种气态烃的分子中所含电子数分别为10、14、16、18,下列关于这四种气态烃的推断正确的是
A. 四种气态烃中至少有两种互为同分异构体
B. 可以用酸性高锰酸钾溶液鉴别乙和丙
C. 丙分子中所有原子均在同一平面上
D. 乙和丁属于同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证铜与稀硝酸反应产生的是一氧化氮而不是氢气.某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去).B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;C中有足量的澄清石灰水,E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球. 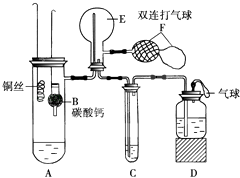
(1)实验时,为了将体系中的氧气排净,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当出现现象时,立刻将B装置上提,使之与稀硝酸脱离,说明已经将装置中的氧气排净;
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为;
(3)用F向E中鼓入空气后,可观察到烧瓶E内的现象是;
(4)装置D的作用是;
(5)有人认为装置存在缺陷,请在不增加其他仪器的情况下,改进该装置: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液中加入过量氨水:Al3++4NH3·H2O![]() AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
B. 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-![]() CaCO3↓+H2O
CaCO3↓+H2O
C. 碳酸钙溶于醋酸:CaCO3+2H+![]() Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
D. 氯化亚铁溶液中通入氯气:2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)下列原子: ![]() C、
C、 ![]() N、
N、 ![]() Na、
Na、 ![]() H、
H、 ![]() U、
U、 ![]() K、
K、 ![]() U中共有种元素,种核素,互为同位素.
U中共有种元素,种核素,互为同位素.
(2)阴离子的中子数为N:AXn﹣共有x个电子,则N= .
(3)有下列物质中NH3、Na2O,CO2、CaCl2、CCl4、H2O2、N2、NaHCO3、NaOH,Na2O2、NH4Cl属于含非极性键的离子化合物的是
(4)下列曲线分别表示元素的某种性质与核电荷数的关系(X为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中: 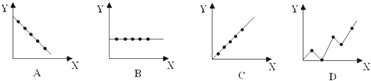
①第ⅡA族元素的最外层电子数;
②第三周期元素的最高化合价;
③碱金属单质的熔点 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质用途的说法中,不正确的是( )
A.Fe2O3可以做油漆的颜料
B.Al2O3可用作耐火材料
C.铝合金比纯铝的熔点更高
D.赤铁矿可用作炼铁的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5molX元素的离子被还原成中性原子时,需要得到6.02×1023个电子,0.4gX的单质与足量盐酸充分反应放出0.02g氢气,X中质子数和中子数相等,Y元素的阴离子结构与氩原子结构相同,它的气态氢化物水溶液是强酸
(1)推断X、Y两元素的名称及在周期表中的位置
(2)用电子式表示X、Y形成化合物的过程.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生探究0.25mol/LAl2(SO4)3溶液与 0.5mol/LNa2CO3溶液的反应,实验如下。
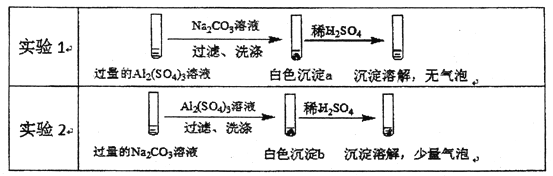
下列分析不正确的是
A. 实验1中,白色沉淀a是A1(OH)3
B. 实验2中,白色沉淀b含有CO32-
C. 实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH有关
D. 检验白色沉淀a、b是否洗涤干净,不可使用相同的检验试剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com