
【题目】恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:2A(g)+B(g) ![]() xC(g)+D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC(g)+D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(1)x=
(2)从反应开始到10s,B的平均反应速率为
(3)从反应开始到40s达平衡状态,A的平均反应速率为
(4)平衡时容器中B的体积分数为
(5)该温度下此反应的平衡常数表达式为 数值是
(6)下列各项能表示该反应达到平衡状态是
A.消耗A的物质的量与生成D的物质的量之比为2∶1
B.容器中A、B的物质的量 n(A)∶n(B) =2∶1
C.气体的平均相对分子质量不再变化
D.压强不再变化
E.气体密度不再变化
【答案】(1)3;(2)0.0075mol/(L·s);(3)0.01mol(L·s)—1 ;
(4)40%;(5)![]() ,0.75;(6)CE。
,0.75;(6)CE。
【解析】
试题分析:(1)根据化学反应速率的表达式,v(A)=(2-1.7)/(2×10)mol/(L·s)=0.015mol/(L·s),化学反应速率之比等于化学计量数之比,v(A):v(C)=0.015:0.0225=2:x,解得x=3;(2) 化学反应速率之比等于化学计量数之比,v(A):v(B)=0.015: v(B)=2:1,v(B)=0.0075mol/(L·s);(3)40s时达到平衡,B的转化率为20%,消耗B的物质的量为2×20%mol=0.4mol,同时消耗A的物质的量0.8mol,v(A)=0.8/(2×40)mol/(L·s)=0.01mol/(L·s);
(4) 2A(g)+B(g)![]() 3C(g)+D(s)
3C(g)+D(s)
起始: 1 1 0 0
变化: 0.4 0.2 0.6
平衡: 0.6 0.8 0.6
B的体积分数为0.8/(0.6+0.8+0.6)×100%=40%;(5)根据平衡常数的定义,K=c3(C)/[c2(A)×c(B)] ,代入数值,解得K=0.63/(0.62×0.8)=0.75;(6)A、无论何时,消耗A的物质的量与生成D的物质的量之比威科2:1,因此不能说明达到平衡,故错误;B、达到平衡时,两者物质的量之比为3:4,不等于2:1,故错误;C、根据M=m/n,D为固体,气体质量减小,反应前后气体系数之和相等,气体物质的量不变,因此当平均摩尔质量不变时,说明反应达到平衡,故正确;D、反应前后气体系数之和相等,因此压强不变,不能说明达到平衡,故错误;E、根据密度定义,气体质量减少,容器是恒容状态,气体体积不变,因此密度不变,说明反应达到平衡,故正确。


科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化,通常表现为热量的变化,如Ba(OH)2·8H2O 与NH4Cl的反应要吸收热量,在化学上叫作吸热反应。其原因是( )。
A.反应物NH4Cl所具有的能量比较低
B.反应物Ba(OH)2·8H2O所具有的能量比较低
C.反应物所具有的总能量高于生成物所具有的总能量
D.反应物所具有的总能量低于生成物所具有的总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定分数是指滴定过程中标准溶液与待测溶液中溶质的物质的量之比。用0.10mol·L-1NaOH溶液滴定0.10mol·L-1H2C2O4(草酸)溶液的滴定曲线如图所示。下列说法不正确的是( )
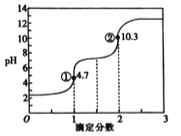
A. H2C2O4属于二元弱酸
B. 若用NaOH标准溶液滴定NaHC2O4溶液,可用酚酞作指示剂
C. 图中①处: c(Na+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
D. 图中②处:c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgH2和Mg2Cu可用作贮氢材料,MgO可用作炉膛内脱硫脱硝的试剂。
(1)MgH2是一种离子化合物,其电子式为_______________。
(2)Mg2Cu在加压条件下储氢时生成MgH2和MgCu2,该反应的化学方程式为_____________。
(3)已知MgH2的有关热化学方程式如下:
MgH2(s) =Mg(s)+H2(g) △H1=+74.4kJ mol-1;
H2(g)+l/2O2(g)=H2O(g) △H2=-241.8 kJ mol-1;
Mg(s)+l/2O2(g)=MgO(s) △H3=-141.6 KJ mol-1。
①氢化镁燃烧生成氧化镁和水蒸气的热化学方程式为______________。
②MgH2作贮氢材料时,单位贮氢材料释放出氢气的质量随时间的变化如图甲所示,其中温度T1、T2、T3由小到大的顺序为__________________。

(4)炉膛内脱除 SO2、NO 反应为2MgO(s)+2SO2(g)+2NO(g)![]() 2MgSO4(s)+N2(g) △H =akJ/ mol,其平衡常数与温度的关系如图乙所示。
2MgSO4(s)+N2(g) △H =akJ/ mol,其平衡常数与温度的关系如图乙所示。
①上述反应的平衡常数表达式为K=_________。
②a_________0(填“>”或“,<”)。
(5)全固态锂离子电池的结构如图丙所示,放电时电池反应为2Li+MgH2=Mg+2LiH。放电时,X极的电极反应式为_________。充电时,Y极的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 xR2++y H++O2=4R3++n H2O的离子方程式中,下列判断正确的是( )
A.y=4,R2+是氧化剂
B.y=2,R2+是还原剂
C.y=2,R3+是还原产物
D.y=4,R3+是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨是一种很好的溶剂,在许多性质方面同水相似,一定条件下金属钠和液氨反应得到NaNH2, NaNH2和N2O反应可以制备化合物甲, 同时还有两种碱性物质生成。取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。请回答:
(1)写岀N2的电子式 。
(2)Na与NH3反应的化学方程式 。
(3)Na和液氨反应还可能生成Na2NH、Na3N,说明理由 。
(4)NaNH2和N2O反应制备甲的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将用导线连接的电极X、Y插入装有硫酸铜溶液的烧杯中(外电路中电子流向如图所示)。据此判断下列说法正确的是( )。
A.外电路中电流方向为X→Y
B.若电极材料分别为锌片和铜片,则Y为锌片
C.X极上发生还原反应
D.若电极材料都是金属,则金属活动性:X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示。若X原子的最外层电子数是内层电子数的2倍,下列说法中正确的是 ( )
![]()
A. X 、Y对应的氧化物都是酸性氧化物
B. X的氧化物不能与Mg发生化学反应
C. Z比Y更容易与氢气化合
D. W与X形成的化合物中化学键类型为共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com