
实验室需用480mL0.10mol/L的硫酸铜溶液,以下操作正确的是
A.将12.00g胆矾配成500mL溶液
B.将12.50g胆矾溶于少量水中,再用水稀释至500mL
C.称取7.68g硫酸铜,加入500mL水
D.在80mL0.6mol/L CuSO4溶液中加入400mL水
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源:2014-2015学年湖北省八市高三年级三月联考理综化学试卷(解析版) 题型:填空题
(15分)氨基甲酸铵(H2NCOONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下方法制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) H2NCOONH4(s) ΔH<0
H2NCOONH4(s) ΔH<0
(1)实验室通常采用图1装置制取氨气,你所选择的试剂是 。
(2)制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。

注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是 。
液体石蜡鼓泡瓶的作用是 。
②从反应后的混合物中分离出产品的实验方法 (填操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
③尾气处理装置如图3所示。能否将浓H2SO4改为稀H2SO4 (填“能”或“否”),理由是 。

(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.570 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为2.000 g。则样品中氨基甲酸铵的质量分数为_______。
[Mr(NH2COONH4)=78、Mr(NH4HCO3) =79、Mr(CaCO3)=100]
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高二上学期期末考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子能在指定环境中大量共存的是
A.pH=13的溶液:SO32-、Na+、AlO2-
B.使甲基橙溶液变红色的溶液:Na+、SO42-、HCO3-
C.在c(H+)=10-12mol/L的溶液:NH4+、Cl-、NO3-
D.加入足量Na2O2后的溶液:K+、Cl-、ClO-
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市高一上学期期末考试化学试卷(解析版) 题型:选择题
以下关于混合物分离提纯操作或原理说法正确的是
A.实验室中用含有Ca2+、Mg2+、Cl-的自来水制取蒸馏水,可采用蒸馏的方法
B.用CCl4萃取碘水的实验中,振荡静置后,下层为紫红色溶液
C.利用植物油的密度比水小的原理,可用分液的方法分离这两种液体混合物
D.蒸馏时,温度计的水银球应充分接触溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市高一上学期期末考试化学试卷(解析版) 题型:选择题
关于物质的量的叙述正确的是
A.常温常压下,4.4gCO2物质的量为0.1 mol
B.常温常压下,6.2g Na2O含有的Na+离子数为0.1mol
C.标准状况下,1 NA 个H2O分子含有氢分子数为1 mol
D.标准状况下,22.4L酒精的物质的量为1mol
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市五校高二上学期期末联考化学试卷(解析版) 题型:填空题
(14)CO2是最重要温室气体,如何降低大气中CO2的含量及有效地开发利用CO2具有重大意义。
(1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.5 mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。

①写出该反应的化学方程式_______________________计算从反应开始到3 min时,氢气的平均反应速率v(H2)=____________________。
②下列措施中一定能使CO2的转化率增大的是___________________ 。(双选、填序号)
A.在原容器中再充入1 mol H2 B.在原容器中再充入1 mol CO2
C.缩小容器的容积 D.使用更有效的催化剂
(2)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。

①上述反应的a________0(填“大于”或“小于”)。
②恒温下,向反应体系中加入固体催化剂,则该反应的反应热a值____(填“增大”、“减小”或“不变”)。
在一定温度下,增大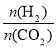 的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市五校高二上学期期末联考化学试卷(解析版) 题型:选择题
关于小苏打水溶液的表述正确的是
A.c(Na+) = c(HCO3-) + c(CO32-) + c(H2CO3)
B.c(Na+)+ c(H+) = c(HCO3-) + c(OH-) + c(CO32-)
C.HCO3-的电离程度大于HCO3-水解程度
D.存在的电离有NaHCO3 = Na+ + HCO3-、HCO3- CO32- + H+、H2O
CO32- + H+、H2O  H+ + OH-
H+ + OH-
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广雅等四校高二上学期期末联考化学试卷(解析版) 题型:填空题
(14分)某工业原料主要成分是NH4Cl、FeCl3和AlCl3。利用此原料可以得到多种工业产品。分析下面流程,回答问题。

已知:Ksp[Fe(OH)3]=4.0×10-38
(1)用稀硫酸中和等体积等pH值的氨水和烧碱溶液,前者需要消耗的酸液体积 (填“大”“小”或“相同”)
(2)计算溶液②中Fe3+的物质的量浓度为 mol/L
(3)缓冲溶液中存在的平衡体系有: 、 、
此时溶液中c(NH4+) c(Cl-)(填>、=、<)。
(4)在缓冲溶液中加入少量盐酸或者NaOH溶液,溶液的pH值几乎依然为9.2。简述原理:
请举出另一种缓冲溶液的例子(写化学式) 。
(5)常温下向较浓的溶液④中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高一上学期期中考试化学卷(解析版) 题型:计算题
(7分)标准状况下,H2和CO的混合气体共8.96L,测得其质量为6.0g,试计算此混合气体中H2和CO的质量和体积各为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com