
已知X为FeO和CuO的混合物,取两份等质量的X样品进行了①、②、③步实验,关系如图(其中固体D不溶于稀盐酸):
(1)写出物质D的化学式: .
(2)若所得固体D的质量为32g,溶液E中只含一种金属离子,气体F在标准状况下体积为5.6L,试计算X中FeO与CuO的质量比(写出计算过程). .

| 无机物的推断.. | |
| 专题: | 推断题. |
| 分析: | X为FeO和CuO的混合物,由转化关系可知,A中含HCl、FeCl2、CuCl2,B中含Fe、Cu,C为CO2,B与A反应生成F为H2,还原性Fe>Cu,则Fe与A中阳离子反应,固体D为Cu,E为一定含FeCl2,以此来解答. |
| 解答: | 解:X为FeO和CuO的混合物,由转化关系可知,A中含HCl、FeCl2、CuCl2,B中含Fe、Cu,C为CO2,B与A反应生成F为H2,还原性Fe>Cu,则Fe与A中阳离子反应,固体D为Cu,E为一定含FeCl2, (1)由上述分析可知,D为Cu, 故答案为:Cu; (2)所得固体D的质量为32g,溶液E中只含一种金属离子,气体F在标准状况下体积为5.6L, a.由Fe+2H+═Fe2++H2↑, 可知与盐酸反应的Fe的质量为: b.由题意一份X中含Cu的质量为32 g÷2=16 g, 由 Cu2++Fe═Fe2++Cu 差量 64 56 8 16g 得16 g Cu2+与Fe反应的差量为 与16 g Cu2+反应的Fe的质量为 所以一份X中含Fe的质量为14 g+14g=28 g, c.X中FeO与CuO的质量比为 故答案为:9:5. |
| 点评: | 本题考查无机物的推断,侧重金属与酸的反应及有关计算的考查,(2)中计算为解答的难点,注意Fe参与的反应分析其质量即可解答,题目难度中等. |


科目:高中化学 来源: 题型:
将1 mol CH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101 kPa,120℃),其总质量为72 g,下列有关叙述错误的是( )
A.若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
B.产物的平均摩尔质量为24 g/mol
C.若将产物通过浓硫酸充分吸收,则压强变为原来的1/3
D.反应中消耗的氧气为56 g
查看答案和解析>>
科目:高中化学 来源: 题型:
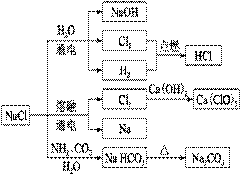
NaCl是一种化工原料,可以制备一系列物质(如右图)。下列说法正确的是
A.25 ℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图中所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
|
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在①稀硫酸 ②液态HCl ③NaOH溶液 ④蔗糖晶体 ⑤Na3PO4固体⑥铜丝⑦液氨 ⑧酒精 ⑨熔融NaCl
上述状态下可导电的是 ①③⑥⑨ ;(填写序号,下同)属于非电解质的是 ④⑦⑧ ;上述状态下的电解质不能导电的是 ②⑤ .
(2)写出下列物质的电离方程式:
H2SO4 H2SO4═2H++SO42﹣ Ba(OH)2 Ba(OH)2=Ba2++2OH﹣ Na3PO4 Na3PO4=3Na++PO43﹣ .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式(Q1、Q2均为正值):
C(s)+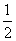 O2(g) = CO(g) ΔH=-Q1 kJ·mol-1,
O2(g) = CO(g) ΔH=-Q1 kJ·mol-1,
C(s)+O2(g) = CO2(g) ΔH=-Q2 kJ·mol-1,
有关上述反应的叙述错误的是
A.Q1<Q2 B.生成物总能量均高于反应物总能量
C.由1 mol C反应生成1 mol CO气体时放出Q1 kJ的热量
D.1 mol CO2气体具有的能量大于1 mol干冰具有的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是
A.K1闭合,铁棒上发生的反应为2H++2e→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
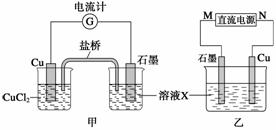
①图中X溶液是_____________________________;
②石墨电极上发生的电极反应式为__________________________________________;
③原电池工作时,盐桥中的____________(填“K+”或“Cl-”)不断进入X溶液中。
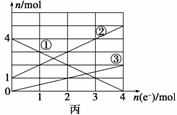
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是__________极; ②图丙中的②线是______________的变化。
③当电子转移为2 mol时,向乙烧杯中加入________ L 5 mol·L-1 NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O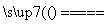 Na2FeO4+3H2↑,则电解时阳极的电极反应式是__________________________________。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是__________________________________。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的Fe、FeO、Fe3O4和Fe2O3的混合物中加入250mL 4mol/L的稀硝酸,恰好使混合物完全溶解。放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现,若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.21mol B.0.25mol C.0.45mol D.0.5mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com