
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是( )
A.Y元素最高价氧化物对应的水化物化学式为H2YO4
B.原子半径由大到小的顺序为:Z>Y>W
C.X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定
D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1∶2
科目:高中化学 来源:2014高考化学二轮专题突破 专题七化学反应与能量练习卷(解析版) 题型:选择题
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
mCeO2 (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2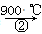 mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是( )
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.图中ΔH1=ΔH2+ΔH3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题7电解质溶液练习卷(解析版) 题型:填空题
已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液 (填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”)。
(2)某温度下,若向0.1 mol/L的NaHA溶液中滴入0.1 mol/L KOH溶液使混合溶液中c(H+)=c(OH-),则此时该混合溶液中,下列关系一定正确的是 (填字母)。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq) ΔH>0
Ca2+(aq)+A2-(aq) ΔH>0
①温度升高时,Ksp (填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+) 。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。T1 ℃时,将9 mol CO2 和12 mol H2充入3 L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线Ⅰ所示,平衡时容器内压强为p1。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线Ⅱ所示。下列说法错误的是( )
CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线Ⅰ所示,平衡时容器内压强为p1。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线Ⅱ所示。下列说法错误的是( )

A.曲线Ⅱ对应的条件改变是增大压强
B.T2℃时,上述反应平衡常数为0.42,则T2>T1
C.在T1℃,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆)
D.在T1℃,若起始时向容器充入4.5 mol CO2、6 mol H2,平衡时容器内压强p=
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题5物质结构 元素周期律练习卷(解析版) 题型:填空题
有关元素X、Y、Z、W的信息如下:
元素 | 有关信息 |
X | 原子半径为0.074 nm,其氢化物的结构模型可表示为: |
Y | 原子半径为0.102 nm,其原子核外电子排布为: |
Z | 人体中必需微量元素中含量最多,体内缺失会引起贫血 |
W | 所在主族序数与所在周期序数之差为4 |
请回答下列问题:
(1)W在元素周期表中的位置是 。
(2)Y与W相比,非金属性较强的是 (填元素符号),下列事实能证明这一结论的是 (填字母)。
a.W元素氢化物的稳定性大于Y元素氢化物的稳定性
b.W元素氢化物水溶液的酸性强于Y元素氢化物水溶液的酸性
c.W元素的单质能与Y元素的氢化物反应,置换出Y单质
d.W的最高价含氧酸比Y的最高价含氧酸的酸性强
(3)Z元素和X元素可形成离子Z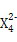 ,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
①Z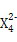 具有强氧化性,能杀菌消毒,还原产物是Z3+。
具有强氧化性,能杀菌消毒,还原产物是Z3+。
②含该离子的盐用作絮凝剂的原因是(用离子方程式和简要的文字说明) 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题4化学反应中的能量变化练习卷(解析版) 题型:填空题
(1)新的《环境空气质量标准》(GB 3095 2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
①汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因 。
②汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ/mol
2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
则反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的ΔH= kJ/mol。
(2)直接排放氮氧化物会形成酸雨、雾霾,催化还原法和氧化吸收法是常用的处理方法。利用NH3和CH4等气体除去烟气中的氮氧化物。已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=a kJ/mol;欲计算反应CH4(g)+4NO(g)=CO2(g)+2H2O(l)+2N2(g)的焓变ΔH2则还需要查询某反应的焓变ΔH3,当反应中各物质的化学计量数之比为最简整数比时,ΔH3=b kJ/mol,该反应的热化学方程式是 ,据此计算出ΔH2= kJ/mol(用含a、b的式子表示)。
(3)下表列出了工业上吸收SO2的三种方法。
方法Ⅰ | 用氨水将SO2转化(NH4)2SO3,再氧化成(NH4)2SO4 |
方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
方法Ⅲ | 用Na2SO3溶液吸收SO2,再经电解转化为H2SO4 |
方法Ⅱ主要发生了下列反应:
2CO(g)+SO2(g)=S(g)+2CO2(g) ΔH=+8.0 kJ/mol
2H2(g)+SO2(g)=S(g)+2H2O(g)ΔH=+90.4 kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol
则S(g)与O2(g)反应生成SO2(g)的热化学方程式可表示为 。
(4)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。

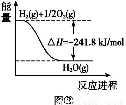
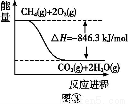
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题4化学反应中的能量变化练习卷(解析版) 题型:选择题
反应A(g)+B(g) C(g) ΔH,分两步进行:①A(g)+B(g)
C(g) ΔH,分两步进行:①A(g)+B(g) X(g) ΔH1
X(g) ΔH1
②X(g) C(g) ΔH2,反应过程中能量变化如图所示,E1表示A(g)+B(g)
C(g) ΔH2,反应过程中能量变化如图所示,E1表示A(g)+B(g) X(g)的活化能,下列说法正确的是( )
X(g)的活化能,下列说法正确的是( )

A.ΔH1=ΔH-ΔH2>0
B.X(g)是反应A(g)+B(g) C(g)的催化剂
C(g)的催化剂
C.E2是反应②的活化能
D.ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题2化学常用计量 溶液练习卷(解析版) 题型:选择题
在200 mL某硫酸盐溶液中含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属阳离子,则该硫酸盐的物质的量浓度为( )
A.1 mol/L B.2.5 mol/L C.5 mol/L D.2 mol/L
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题12化学实验基本操作与方案设计练习卷(解析版) 题型:选择题
下述实验能达到预期实验目的的是( )
序号实验内容实验目的
A室温下,用pH试纸测定浓度为0.1 mol·L-1NaClO溶液和0.1 mol·L-1 CH3COONa溶液的pH 比较HClO和CH3COOH的酸性强弱
B向盛有1 mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液说明一种沉淀能转化为另一种溶解度更小的沉淀
C向NaAlO2溶液中滴加饱和NaHCO3溶液,有白色沉淀产生验证两者都发生了水解反应,且相互促进
D室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入不同浓度的稀硫酸研究浓度对反应速率的影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com