
A、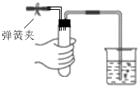 如图装置中,用手捂住试管,烧杯中出现气泡,手放开后,导管中形成一段稳定的水柱 |
B、 如图装置中,向长颈漏斗中加一定量水,并形成水柱,随后水柱下降至瓶中液面相平 |
C、 如图装置中,双手捂住烧瓶,导管中形成一段稳定的水柱,双手放开后,水柱慢慢回落 |
D、 如图装置中,将a管向上提至一段高度,a、b两管之间水面形成稳定的高度差 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该有机物与浓溴水可发生取代反应 |
| B、1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH |
| C、该有机物与浓硫酸混合共热可发生消去反应 |
| D、该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
| 制备并收集氨气 | 比较Na2CO3与NaHCO3的稳定性 | 用NaOH溶液滴定锥形瓶中的盐酸溶液 | 制备乙酸乙酯 |
 |  |  |  |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )可由下列路线合成:
)可由下列路线合成:| HBr/过氧化物 |
| Br2/红磷 |


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com